
今日,阿斯利康已就对亘喜生物科技集团(纳斯达克股票代码:GRCL;简称“亘喜生物”)收购提案签署最终协议,进一步深化阿斯利康在细胞疗法领域布局。此次拟议收购将为阿斯利康不断扩充的细胞疗法管线增添GC012F CAR-T细胞疗法。基于FasTCAR技术平台打造的GC012F是一款处于临床阶段的创新型BCMA/CD19双靶点自体嵌合抗原受体T细胞疗法(CAR-T),有望成为针对多发性骨髓瘤、其他多类恶性血液肿瘤以及自身免疫性疾病(包括系统性红斑狼疮(SLE))的新一代治疗方案。自体CAR-T细胞疗法的原理是通过重新编辑修饰患者自身的免疫T细胞,使之靶向攻击致病细胞以治疗疾病,其生产制备过程较为复杂且耗时较长。亘喜生物的FasTCAR次日生产技术平台,不但能显著缩短生产时间,还能强化T细胞健康状态,进而有望提高自体CAR-T疗法的有效性。该技术未来也有望应用于治疗罕见病。亘喜生物将作为阿斯利康全资子公司继续在中国及美国运营。根据最终协议条款,阿斯利康将合并收购亘喜生物的所有稀释后股份(包括所有ADS代表的股份)。阿斯利康将在交易交割时,以普通股(“普通股”)每股现金价格2美元(相当于每股ADS10美元)完成收购。此外,条款中还附加了一项不可交易的或有价值权益,阿斯利康将在达到特定监管相关里程碑时,支付普通股每股现金价格0.3美元(相当每股ADS 1.5美元)。交易对价中的现金首付部分的交易价值约为10亿美元,较之亘喜生物在2023年12月22日的收盘价溢价62%,比公告发布前的60天成交量加权平均价格(VWAP)3.94美元溢价154%。如果这笔首付款以及潜在的或有价值付款达成的话,合计交易价值约为12亿美元,较之亘喜生物在2023年12月22日的收盘价溢价86%,比60天的VWAP溢价192%。作为拟议交易的一部分,阿斯利康将获得亘喜生物资产负债表上剩余的现金、现金等价物及短期投资。截至2023年9月30日,亘喜生物资产负债表上的现金、现金等价物和短期投资总额为2.341亿美元。该交易预计将于2024年第一季度交割,具体取决于惯常的交割条件、包括监管部门的批准,以及亘喜生物股东的批准。该交易不影响阿斯利康2023财年业绩指导。
亘喜生物成立于2017年,致力于发现和开发突破性细胞疗法用于治疗癌症及自身免疫性疾病,2021年在美国纳斯达克上市。目前市值5.94亿美元。根据2023年Q3季度报告,亘喜当季研发支出为0.901亿元(折合1230万美元),上年同期为1.334亿元。减少的主要原因是研究、开发和临床试验的支出减少。2023年8月7日,亘喜生物曾宣布与多家知名投资机构达成至多1.5亿美元私募配售融资,本次超额认购的融资交易由Vivo Capital领投,国际知名医疗行业机构投资者Adage Capital Partners LP等,当时透露总融资额预计可支持公司日常运营至2026年下半年。亘喜生物拥有一整套专有的基因工程改造技术,包括双特异CAR和增强型CAR,可与公司自主研发的 FasTCAR 和 TruUCAR 技术平台相结合,进一步增强CAR-T候选产品的治疗效果。在传统的CAR-T生产过程中,首先使用CD3和/或CD28抗体激活患者的T细胞,然后以病毒载体转导,以表达一种或多种CAR。这些经过改造的CAR-T细胞在被注射回人体前会在体外进行扩增,生产过程整体通常需要1到6周。亘喜凭借专有的FasTCAR平台,能够使用来自慢病毒且具有高质量、并表现出高基因转导效率的XLenti载体,同时激活和转导处于静息状态的T细胞。在转导后,一种或多种CAR会整合到T细胞基因组中并稳定表达。基于亘喜的临床前研究,经过转导的 T 细胞具有较高的扩增和肿瘤细胞清除活性,去除了体外细胞扩增步骤的必要性,可直接成剂、给患者使用。基于这样的创新,FasTCAR技术能将激活、转导和扩增步骤转化为一个单一的“同步激活-转导”步骤。如下图所示,该技术能将自体CAR-T细胞生产时间从行业标准的1到6周,显著缩短到次日生产完毕。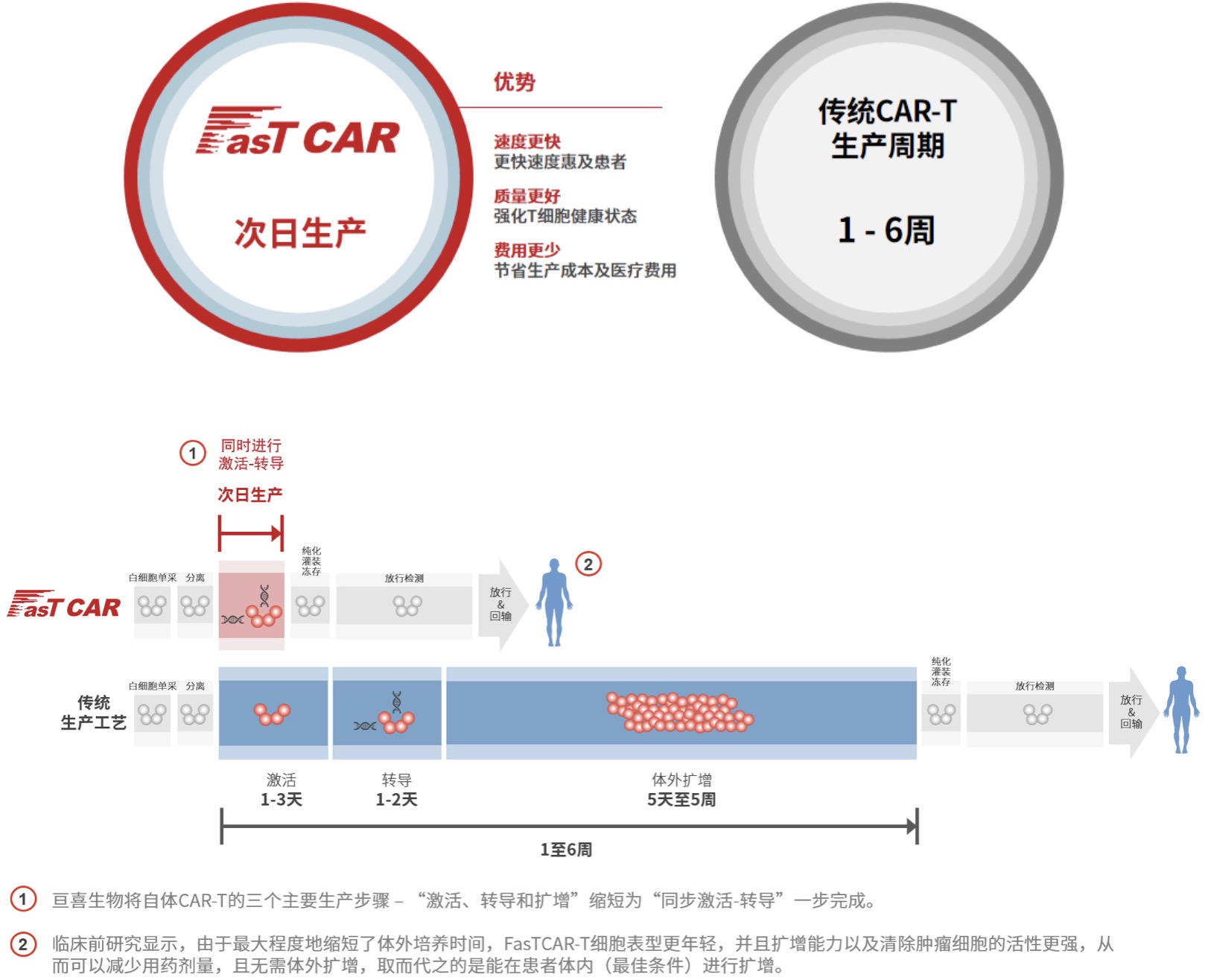
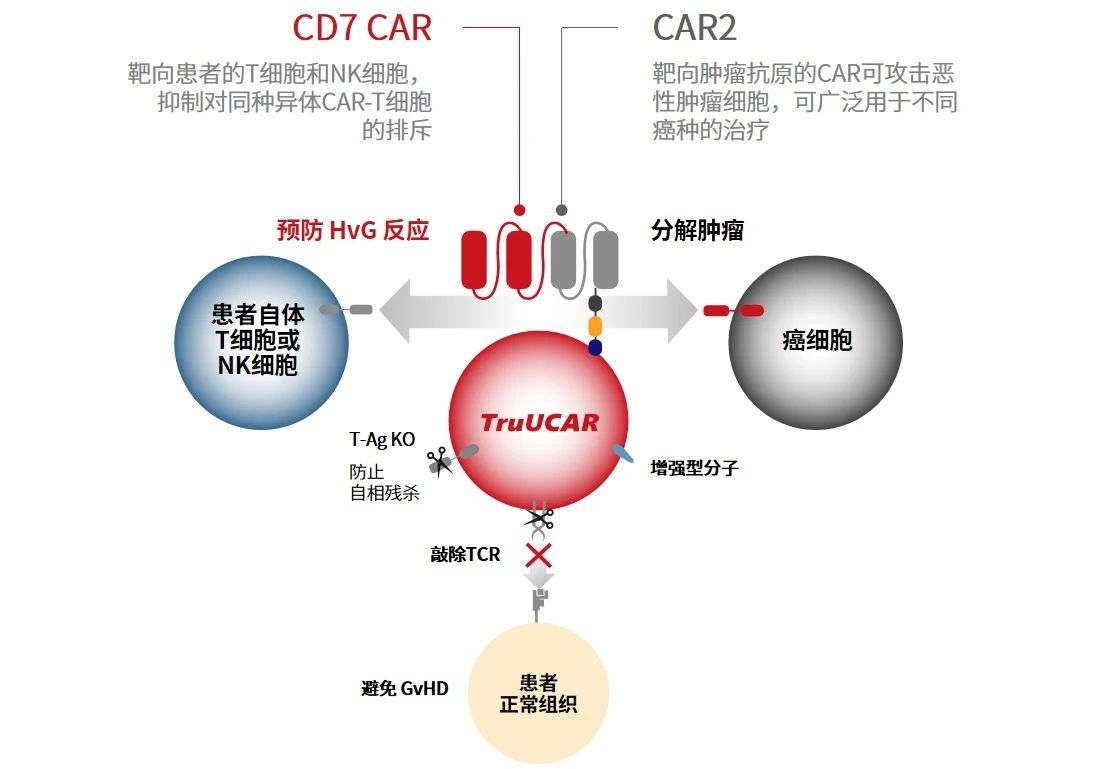
TruUCAR是亘喜生物的同种异体CAR-T疗法专有平台,能以较低成本打造出“通用型”产品。为降低同种异体T细胞引发的移植物抗宿主病(GvHD)风险,亘喜生物利用CRISPR/Cas9 去破坏T细胞受体 α 恒定 (TRAC) 位点,以消除TruUCAR候选产品TCR复合物的表面表达。此外,为消除潜在的“内耗”现象(CAR-T细胞间互相杀伤),亘喜利用CRISPR/Cas9破坏了CD7—— 一种CAR-T细胞上表达 pan T 和 NK的标记 。TruUCAR的模块化平台提供了设计上的灵活性,以便于针对不同抗原,调整、替换CAR的构型。例如,抗HvG和抗GvHD功能可以通过双特异CAR设计或单CAR设计来实现双特异性功能。在采用双特异CAR设计的情况下,一种CAR用于“防御”,靶向患者自身会进行同种异体反应性杀伤的T细胞和NK细胞,保护CAR-T细胞不被排斥;而第二种CAR则用于“ 攻击”,靶向肿瘤抗原以清除肿瘤细胞。在采用单一CAR设计的情况下,CAR执行双重功能,既靶向会进行同种异体反应杀伤的T细胞和NK细胞,也靶向T肿瘤细胞。此外,该产品的设计中,还将一个增强型分子嵌入到TruUCAR的基础结构中,以提升TruUCAR T细胞的扩增能力。
除了GC012F之外,亘喜生物的研发管线还有多款创新产品,包括CD19/CD7 GC509,针对实体瘤的Claudin18.2 GC506,以及CD19/CD7 GC502、BCMA/CD7 GC508两款通用CAR-T疗法。

1、GC012F—— BCMA/CD19 自体CAR-TGC012F是亘喜生物核心资产,是一款基于亘喜生物专有的FasTCAR技术平台开发的BCMA/CD19双靶点自体CAR-T细胞疗法,有望变革性地为癌症和自身免疫性疾病治疗带来快速、深入且持久的效果,并具备差异化的安全性优势。目前,该公司正在开展GC012F的多项临床研究,适应症覆盖难治性系统性红斑狼疮(rSLE)、复发性或难治性多发性骨髓瘤(RRMM)、新确诊的多发性骨髓瘤(NDMM)以及B细胞非霍奇金淋巴瘤(B-NHL)等。- 针对rSLE适应症的NDMM IIT临床试验的最新研究临床数据显示,总体应答率(ORR)为100%,微小残留病灶阴性的严格完全缓解率(MRD- sCR)为95.5%,且安全性继续保持既往优异的结果。今年11月,FDA批准亘喜生物针对rSLE的I期临床试验, 12月rSLE临床国内获批。
- 针对RRMM适应症,2023年2月,亘喜生物宣布FasTCAR-T GC012F治疗RRMM的新药临床试验申请已先后获得美国FDA和中国国家药监局(NMPA)批准,相关临床试验即将启动。
2、GC502—— CD19/CD7 异体CAR-TGC502是一款通用型同种异体CD19/CD7双靶向CAR-T疗法。在2022年美国癌症研究协会(AACR)年会公布GC502截至2022年1月28日的FIH研究数据,结果显示:- 4名入组的r/r B-ALL患者,接受了两种不同剂量水平和两种不同配方的治疗。值得一提的是,所有患者此前均接受过深度的既往治疗,包括都曾接受了自体或供者来源的靶向CD19或靶向CD19/CD22的CAR-T细胞治疗;
- 4名患者中有3名患者达到了微小残留病灶阴性的完全缓解/血细胞数量未完全恢复的完全缓解(MRD-CR/CRi);
- 1名患者在1个月时达到了部分缓解,随后在第39天接受了同种异体造血干细胞移植;
在安全性方面,总体耐受良好,所有不良反应都可控、可逆。1、2023年11月,AZ合作与投资Cellectis今年11月,阿斯利康曾宣布与临床阶段的生物技术公司Cellectis达成合作和投资协议,以加速在肿瘤学、免疫学和罕见病等高度未满足需求的领域开发下一代疗法。根据合作协议的条款,阿斯利康将利用Cellectis专有的基因编辑技术和制造能力,设计新型细胞和基因治疗产品,加强阿斯利康在这一领域不断增长的产品。作为协议的一部分,阿斯利康专门保留了25个基因靶点,从中可以探索多达10个候选产品进行开发。Cellectis将于今年第四季度从阿斯利康获得1.05亿美元首付款,其中包括根据研究合作协议条款支付的2500万美元预付款和8000万美元的股权投资。此外,Cellectis还有资格从10种研究性新药(IND)获得期权费和开发、监管和销售相关的里程碑付款,每种候选产品每款从7000万美元到2.2亿美元不等,外加分级特许权使用费。阿斯利康保留根据研究合作协议开发的候选产品的全球独家许可选择权,该许可将在IND申报之前行使。2、2023年6月投资Quell Therapeutics2023年6月,阿斯利康宣布与Quell Therapeutics达成协议,根据协议Quell将获得阿斯利康8500万美元的预付款,后续有资格进一步获得超过20亿美元的开发和商业化里程款。双方将利用Quell专有的Treg细胞工程模块工具箱,开发用于自身免疫性疾病的自体多模块Treg细胞候选疗法。这些疗法有可能治愈I型糖尿病(T1D)和炎症性肠病(IBD)。此外,Quell将保留其主要Treg细胞治疗候选药物QEL-001的全部所有权以及正在进行的神经炎症临床前项目。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容




