
2025-09-11 17:07:38来源:医麦客浏览量:639

2025 年 9 月 11 日
医麦客新闻 eMedClub News
9 月 8 日晚,国家药品监督管理局药品审评中心(CDE)发文就《先进治疗药品沟通交流中 I 类会议申请及管理工作细则》征求意见。这一意见旨在优化先进治疗药品(ATMPs)的沟通交流流程,显著缩短审评对话周期,推动细胞与基因治疗等创新药品早日上市。

细则关键内容显示,只要满足下列任一条件,可直接按 I 类会议管理,加快沟通效率,缩短沟通时限为 30 日:1、已纳入突破性治疗药物程序的 ATMPs;2、针对基因突变/缺陷等导致的相关疾病,可对病因进行治疗的基因治疗产品;3、完成探索性临床试验后,申请关键性/确证性临床试验启动前、关键性/确证性临床试验期间、以及新药上市许可申请前沟通交流会议的 ATMPs。
细则强调,与现行《药物研发与技术审评沟通交流管理办法》(2020 年第 48 号)衔接,未新增企业负担。业内专家指出,这一最新细则直击 ATMPs 研发痛点:基因治疗、细胞治疗产品常因技术新颖性面临沟通效率瓶颈。通过将关键节点沟通纳入快速通道,有望压缩研发周期 6-12 个月,推动我国先进疗法与国际同步。

▲ 2013-2023 年,Emily 往年「打卡照」
(2024 年起,Emily 表示不再更新打卡照)
众所周知,曾身患绝症的女孩 Emily 在 CAR-T 细胞治疗下实现治愈,迄今无癌生存 13 年。在我国,当下也已有共 7 款 CAR-T 细胞治疗产品获批上市,其中传奇生物的西达基奥仑赛更是率先出海美国,今年上半年销售额已达 8.08 亿美元,成为行业熟知的重磅炸弹药物将是板上钉钉的事。那么后来者如何切入这样一个极具前景的赛道?这个赛道又有哪些技术瓶颈和挑战呢?
由于 CAR-T 细胞具有独特生物学特性的活细胞,不完全受我们控制,被称为「活药物」。其在制造过程需要额外的监督和严格控制,以确保细胞的安全和有效。 CAR-T 细胞制造的精细过程始于从患者血液中提取 T 细胞。CAR 基因通过病毒载体、转座子系统或直接 mRNA 转导传递给这些细胞。最终产生的 CAR 蛋白在细胞表面得到表达。最后,CAR-T 细胞在生物反应器中扩增(繁殖),然后准备回输到患者体内。
质量控制
由于 T 细胞是活体的,CAR-T 细胞开发者们依赖生物过程来构建它们。因此,开发者必须执行几个质量控制(QC)步骤,以确保这些细胞疗法的功能和安全性。
首先,在转染过程中,CAR 基因将随机整合到 T 细胞基因组的不同位置。这个过程必须密切监测。如果转基因整合到基因组的非编码区域,它将永远不会表达。该基因还可能干扰癌基因并促进肿瘤生长。
此外,制造商需要精确控制每个 T 细胞中的转基因拷贝(copies)数。CAR 拷贝数过低,表示 CAR 表达量不足,T 细胞无法有效识别并杀伤肿瘤细胞,导致治疗无效;CAR 拷贝数过高,可能引发 T 细胞过度激活,导致细胞耗竭或过早死亡,缩短其在体内的存活时间,降低长期疗效。甚至引发全身性炎症反应(CRS),导致器官损伤和死亡。因此为了确保患者的安全和药物的疗效,监测 CAR 基因的拷贝数以及转基因整合到患者 T 细胞中的位置对于 CAR-T 细胞制造商至关重要。
美国 FDA 建议,对于使用逆转录病毒或慢病毒载体的细胞疗法,每个基因组中应≤5 个拷贝/细胞,以减轻由插入性诱变引起的临床风险。较高的拷贝数可能导致 CAR-T 细胞对患者产生毒性作用。
再者,通过检测回输前细胞的 CAR 拷贝数,可以预估体内扩增潜力,优化细胞剂量。同时,在治疗开始后,通过追踪 CAR 拷贝数变化,评估细胞在体内的持久性和扩增状态,为后续治疗提供依据。
分析方法
科学家通常使用定量聚合酶链式反应(qPCR)来计算 CAR 基因整合。然而,qPCR 只能产生相对的定量结果,需要一个标准曲线进行比较。为了制作标准曲线,生物制造商需要对标准样品进行连续稀释,这是一个耗时、复杂的过程,往往成为实验差异性的根源。此外,qPCR 不能检测每个细胞中单个拷贝的整合;它的灵敏度限制在每个细胞至少有两个或三个拷贝。
而另一种更灵敏的定量 CAR 基因拷贝数的方法是 Droplet Digital PCR(微滴式数字 PCR,ddPCR)分析。qPCR 和 ddPCR 的原理相似,均使用标准试剂、引物和探针。然而,qPCR 每管只能执行一个 PCR 反应,而 ddPCR 技术涉及将样本分成数万纳米升大小的液滴,每一个液滴中都独立进行 PCR 扩增。如果液滴中包含目标序列(CAR 转基因),那么它将被扩增,荧光探针将发出可检测的信号。是否可被检测的结果将被收集起来,最终比 qPCR 提供更精确的定量结果。通过计算含有转基因的液滴百分比,科学家可以确定样品中该基因的浓度,并从中得出 T 细胞基因组中该基因的平均拷贝数。
主要优势:
1. 无需标准品(标准曲线),对靶标分子实现绝对定量;
2. 可以实现 0.01% 或以上的突变检出率,更高的灵敏度;
3. 有效区分浓度差异(变化)微小的样品,更高的精密度和重复性;
4. 不依赖扩增效率,能克服 PCR 抑制剂的影响,特别适合基质复杂样本的检测;
5. 操作过程和结果分析简单。
ddPCR 技术流程:
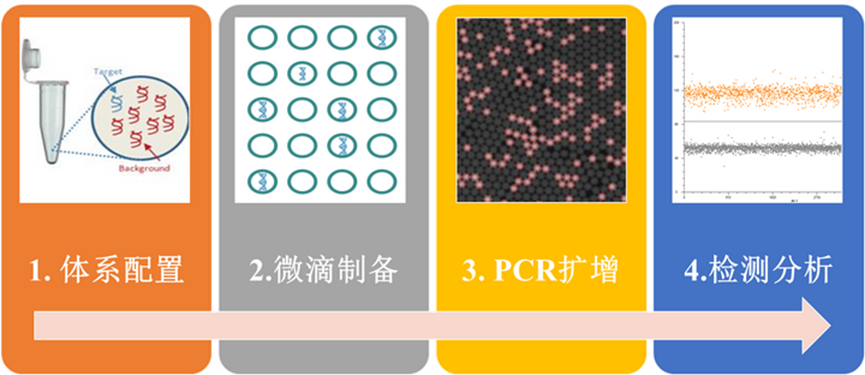
其他质控应用
ddPCR 不仅用于 CAR-T 细胞制造和安全性测试的上述领域,还可用于监测经过基因工程改造的细胞的持久性和活性,解决对细胞安全性的担忧。
例如,FDA 担忧 CAR-T 细胞的复制可能导致患者体内形成快速进展的 T 细胞肿瘤。为确保安全,FDA 建议科学家测试临床批次、细胞产品及 CAR-T 治疗患者的血液。
ddPCR 可检测 CAR-T 细胞中的复制病毒,筛选受感染细胞,并检测其他微生物污染来源。 ddPCR 还可用于检测 CAR-T 细胞在患者治疗后的持久性。这些细胞应在人体内存活数月。若存活时间不足,疗效有限;若持续过久,可能产生不良副作用。病理学家可利用 ddPCR 定期监测血液中的 CAR-T 细胞计数,跟踪细胞的持久性。
总的来说,ddPCR 可以协助确保 T 细胞含有正确数量的 CAR 基因拷贝,从而使治疗安全有效。未来 ddPCR 将可能进入更多的临床实验室,帮助改善 CAR-T 细胞治疗的多个方面,并帮助其在未来的个性化癌症治疗中提供更准确和有效的治疗方案。

在最为知名的 CAR-T 细胞检测之外,ddPCR 技术还在 AAV 基因疗法、质粒、活菌和 mRNA 等产品的质量分析中也扮演着非常重要的角色。2025 年 9 月 12 日(周五),一场汇聚全球顶尖专家的行业技术交流会 Droplet Digital PCR World 2025 将在线上举办。这一会议邀请到多位 CGT 领域专家,聚焦细胞基因治疗产品开发、生产和质控,共话技术研究,助力加速 CGT 产品商业化进程。点击扫描下图或文末「阅读原文」即可参与报名。

参考资料:
1.https://www.cde.org.cn/main/news/viewInfoCommon/ad53943229c9edd2e708f79c9053e38e
2.https://mp.weixin.qq.com/s/_WPLPog30jKZWBVT1xz1xg
3.https://mp.weixin.qq.com/s/4xRuKKwgWMwDr-RJby_e0A
4.https://mp.weixin.qq.com/s/B5xb5ux0SHjp14wd9SruUA
5.https://mp.weixin.qq.com/s/coQgcg82bpHOApr41bLRbQ