2月16日,Iveric Bio发布公告,宣布补体C5抑制剂Zimura(avacincaptad pegol,ACP)用于治疗年龄相关性黄斑变性(AMD)继发地图样萎缩(GA)的新药申请(NDA)获FDA优先审评,PDUFA日期为2023年8月19日。这是全球第2款申报上市的GA疗法,也是全球第4款申报上市的补体C5靶向疗法。
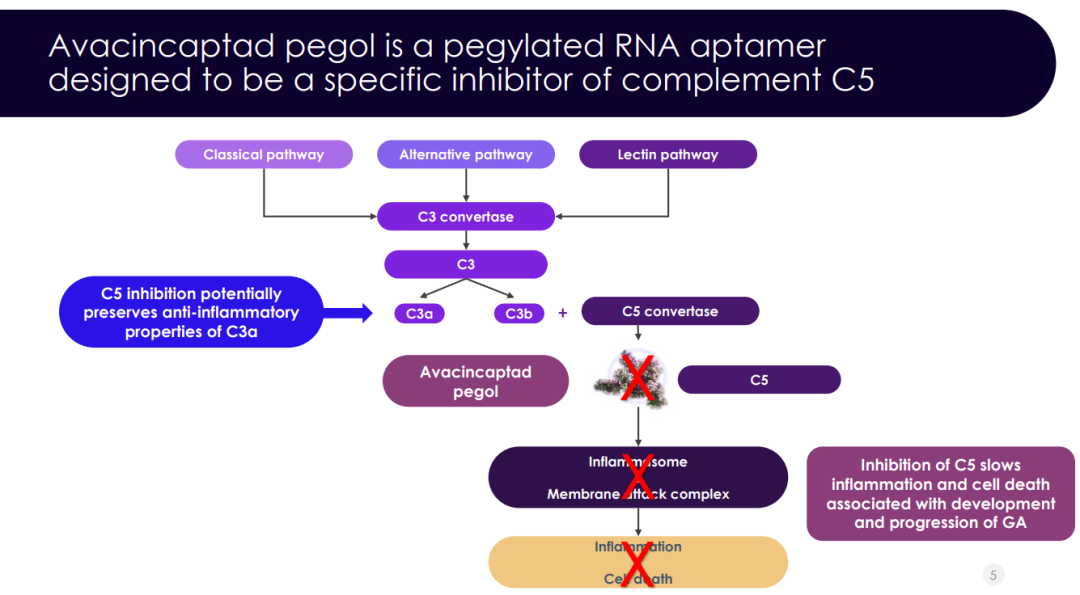
GA是AMD的一种晚期表现,因感光器、视网膜色素上皮 (RPE) 和下方脉络膜毛细血管的丧失所致,可导致视觉功能进行性和不可逆转丧失。这种进行性疾病会严重降低患者的生活质量,因为它会在2.5年内慢慢侵犯视网膜中央凹区,而该区对中央视力至关重要。目前尚无GA疗法获批上市。Zimura是一种旨在抑制补体C5蛋白的聚乙二醇化RNA适配体,最早由Archemix开发。2007年8月,Iveric与Archemix达成许可协议,获得Zimura作为眼科药物的全球开发和商业化权益。研究人员认为,补体系统和C5蛋白的过度激活在与AMD继发GA相关的瘢痕和视力丧失的发生发展中起关键作用。通过阻断C5蛋白的活性,Zimura可能会降低导致视网膜细胞退化的补体系统的活性,并可能减缓GA的进展。该产品于2020年4月获FDA授予快速通道资格。
Zimura的作用机制(来源:Iveric官网)
此次NDA是基于2项III期临床试验(GATHER1和GATHER2)的积极结果。GATHER1和GATHER2研究分别纳入286例和448例患者,旨在评估Zimura治疗AMD继发GA患者的疗效和安全性。共同的主要终点为第12个月时GA病变面积的平均变化率。两项研究的结果均显示,相比于安慰剂组,Zimura组患者的GA病变面积的平均生长速率显著下降。在GATHER1研究中,与安慰剂组相比,Zimura(2mg)组患者的GA病变面积的平均生长速率降低了27.38%(p=0.0072),Zimura(4mg)组降低了27.81%(p=0.0051)。
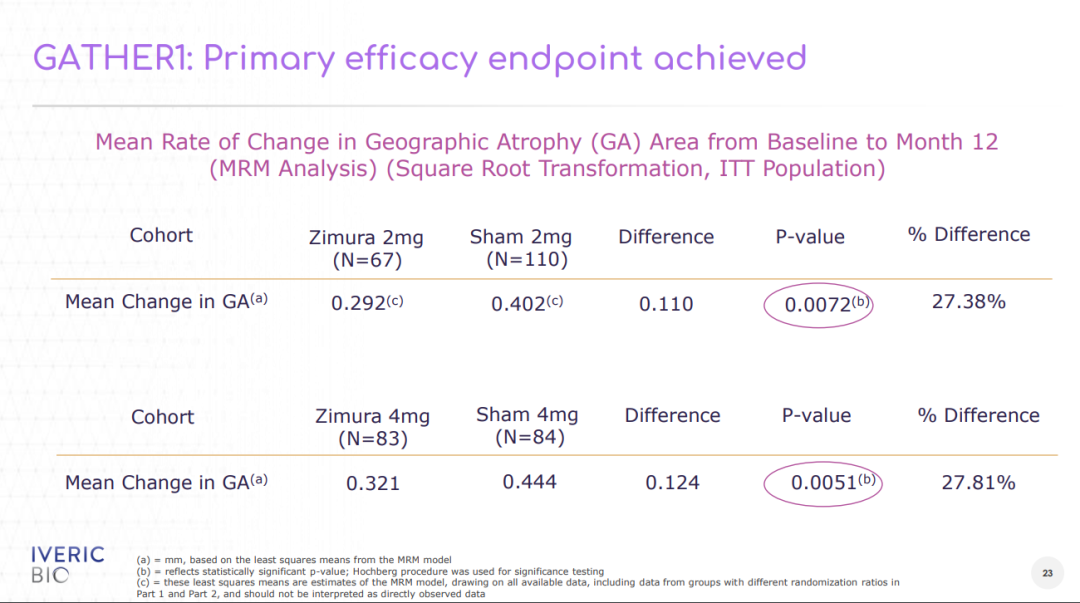
GATHER1研究的主要终点结果(来源:Iveric官网)
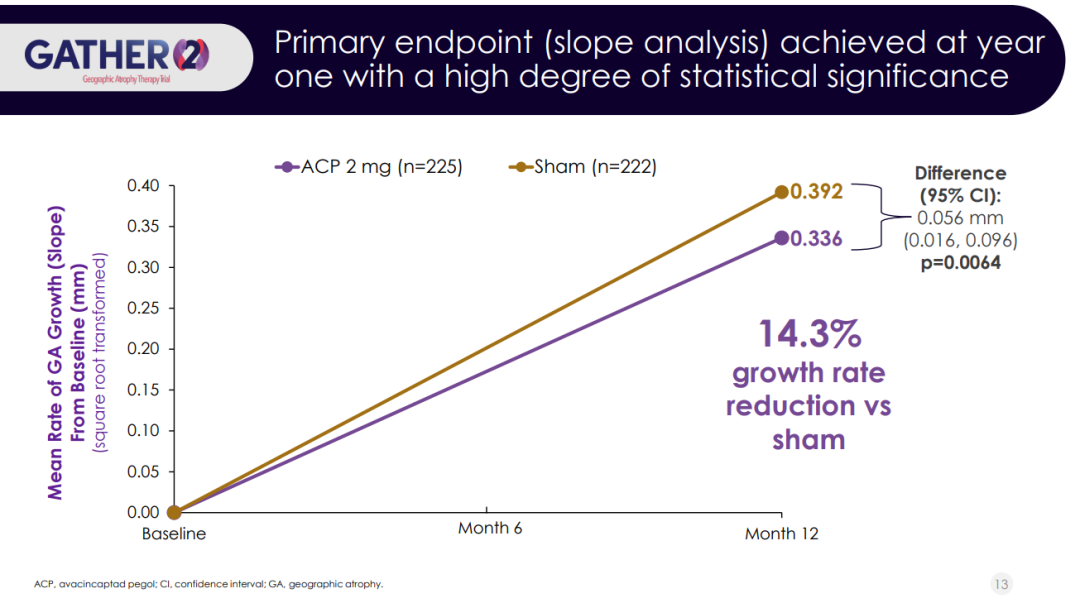
在GATHER2研究中,与安慰剂组相比,Zimura(2mg)组患者的GA病变面积的平均生长速率降低了14.3%(p=0.0064)。Iveric Bio还分析了第12个月时患者的最佳矫正视力(BCVA)和低亮度最佳矫正视力(LL BCVA)的平均变化。数据显示,Zimura组患者的BCVA改善优于安慰剂组,且与GATHER1研究一致,但未观察到患者的LL BCVA显著改善。
在Zimura之前,第一款GA疗法pegcetacoplan(Apellis和Swedish Orphan Biovitrum合作开发)已在2022年6月率先申报上市并获FDA优先审评,PDUFA日期为今年2月。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容