3月13日,基石药业宣布,其合作伙伴Blueprint Medicines公司近日在2023年美国过敏、哮喘和免疫学会(AAAAI)年会上公布了泰吉华(阿伐替尼片)治疗惰性系统性肥大细胞增多症(ISM)患者的PIONEER研究详细数据。结果显示,阿伐替尼在总症状评分方面取得了统计学显著性与有临床意义的改善,并随着时间的推移而加深,所有类型的症状均有改善。此外,阿伐替尼在肥大细胞增多症生活质量问卷(MC QoL)显示出具有统计学显著性与临床意义的改善。

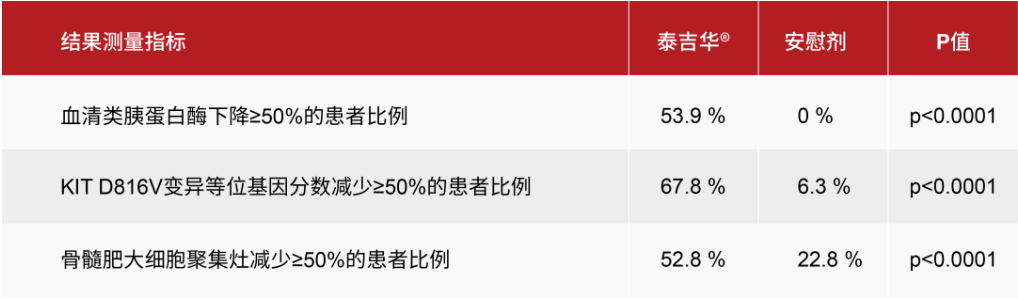
系统性肥大细胞增多症(SM)是一种罕见的疾病,大约95%的患者是由KIT D816V突变引起的。肥大细胞失控性的增殖和激活导致多器官系统出现各种慢性、严重和突发症状。大多数患者为患有非晚期(即惰性与冒烟型)SM,其中绝大多数患者患有惰性系统性肥大细胞增多症(ISM)。目前,全球范围内尚无批准的治疗非晚期SM的疗法。阿伐替尼是一款强效、高选择性、口服针对KIT和PDGFRA突变的激酶抑制剂,基石药业与Blueprint Medicines公司达成独家合作和授权协议,获得了其在大中华地区(包括中国大陆、香港、澳门和台湾地区)的独家开发和商业化权利。此前,中国国家药品监督管理局(NMPA)已批准阿伐替尼以商品名泰吉华上市销售,用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可切除性或转移性胃肠道间质瘤(GIST)成人患者。根据基石药业新闻稿,PIONEER是一项随机、双盲、安慰剂对照、注册研究,旨在评估阿伐替尼治疗惰性系统性肥大细胞增多症患者的疗效与安全性。该研究包括三个阶段:第1部分为剂量发现研究,第2部分为注册性研究,第3部分为开放标签扩展研究。该研究的关键研究终点包括通过ISM症状评估表(ISM-SAF)总症状评分(TSS)评估的患者报告的疾病症状变化、患者报告的生活质量、肥大细胞负荷的测量和安全性。完成第1部分或第2部分的患者有资格参加第3部分研究。所有患者在第3部分接受阿伐替尼治疗,包括从安慰剂组交叉的患者。此次PIONEER研究更新结果与此前报道的一致,阿伐替尼在主要和所有关键次要终点均具有统计学显著性与临床意义的重大改善。更新的结果进一步证实了阿伐替尼在病理性肥大细胞负荷、疾病症状——包括总症状评分、最严重的症状和所有类型症状,以及生活质量方面均具有获益。阿伐替尼治疗的患者在各个临床指标上均可见48周内的改善持续加深。此外,阿伐替尼耐受性良好,安全性优于安慰剂组,阿伐替尼治疗的患者中96%选择在开放标签扩展研究中继续接受该治疗。
- 在24周时,与安慰剂相比,阿伐替尼在所有病理性肥大细胞负荷指标上均实现了快速、持久和统计学显著的降低。
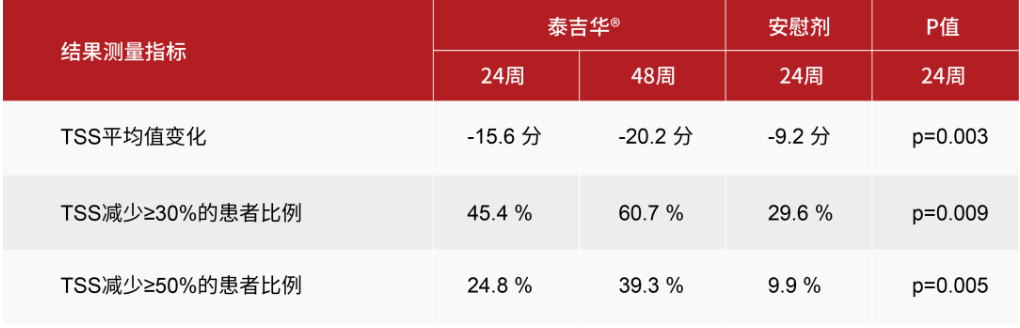
- 在24周时,与安慰剂相比,阿伐替尼在TSS方面取得了统计学上显著且临床上有意义的改善,在ISM-SAF所测量的所有类型的症状中都有改善,且随着时间的推移而加深。
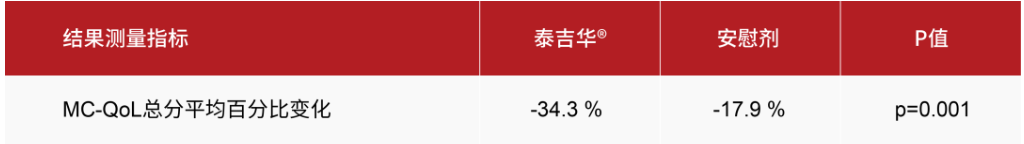
- 在24周时,与安慰剂相比,阿伐替尼在肥大细胞增多症生活质量问卷(MC QoL)总分的平均百分比变化方面具有统计学显著性与临床意义的改善。
与安慰剂相比,阿伐替尼具有良好的耐受性和安全性,支持ISM长期治疗的临床需求。具体如下:
- 在所有治疗组中,大多数不良事件(AEs)均为轻度至中度,导致停药的治疗相关AEs在两组中均较低(分别为1.4%)。
- 与阿伐替尼组(5.0%)相比,安慰剂组报告的严重不良事件更高(11.3%)。
- 最常见的治疗相关不良事件(≥5%)是头痛、恶心、外周水肿、眶周水肿和头晕。大多数水肿AEs为1级,没有导致治疗中止的情况。
基于PIONEER研究数据,Blueprint Medicines已经向美国FDA提交了阿伐替尼的补充新药申请(sNDA),并向欧洲药品管理局(EMA)提交了阿伐替尼的2型上市许可申请变更(MAA),用于治疗惰性系统性肥大细胞增多症(ISM)患者。FDA已经授予阿伐替尼该项申请的优先审评资格,PDUFA日期为2023年5月22日,同时,EMA已经确认了阿伐替尼的MAA。
[1]基石药业宣布泰吉华(阿伐替尼片)治疗惰性系统性肥大细胞增多症的积极研究数据在美国过敏、哮喘和免疫学会(AAAAI)年会上公布. Retrieved Mar 13 , 2023. From https://mp.weixin.qq.com/s/8yn_l8wEcZ1ruXRbbLzy6g
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容