
2023-07-21 00:00:00来源:陶术浏览量:669
新药的开发是一个复杂的过程,从最初的靶标发现到最终成药可能需要12-15年的时间,成本可达十亿美元甚至更多。靶标的发现可以来自各种来源,包括学术研究、临床研究以及商业计划等。
药物开发计划的启动,是因为有一种疾病或临床状况没有合适的医疗产品可用,这种未满足的临床需求正是该项目的潜在驱动因素。在为一项耗资巨大的药物开发计划选择靶标之前,可能需要多年的时间来建立具备支持性的证据,以确定具有适当特征的分子,从而制造目标药物。
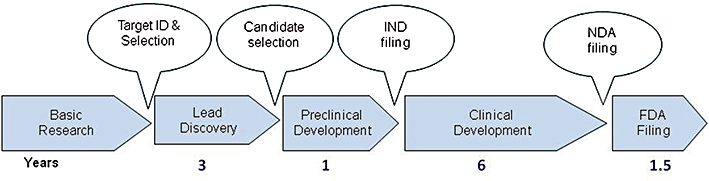
药物发现过程时间表
在临床上的失败药物主要有两个原因。第一个原因是因为它们没有作用,第二个原因是因为它们不安全。因此,在开发新药物的过程中,最重要的步骤之一是确定和验证药物的靶点。
这里的靶点是一个广义的术语,囊括了蛋白质、基因、RNA等。一个好的靶点需要具有疗效、安全性、满足临床和商业需求,最重要的是“可成药“。
靶点的确定主要基于生物医学数据的可用性。可用的数据来自各种来源,包括出版物、专利信息、基因表达数据、蛋白质组学数据、转基因表型以及化合物筛选数据等等。
确定靶点的方法还包括,检查mRNA/蛋白质水平,以确定它们是否在疾病中表达、是否与疾病的恶化或进展相关联;遗传多态性与疾病的进展或风险是否相关,或者多态性是否起着作用。例如:家族性阿尔茨海默病(AD)患者通常在淀粉样前体蛋白或前蛋白酶基因中有突变,导致大脑中产生并沉积大量与AD特征相关的Aβ肽。
还有一种选择靶点的方法是 使用表型筛选来识别与疾病相关的靶点。例如,Kurosawa等使用噬菌体抗体库来分离结合于肿瘤细胞表面的人单克隆抗体(mAbs)。克隆体通过免疫染色逐个进行筛选,选择出对恶性细胞有优先和强烈染色的抗体。然后,通过免疫沉淀分离并通过质谱鉴定了这些克隆体识别的抗原,其中一些可能是相应癌症治疗的有用靶点[2]。
(PS:关于免疫染色可查看小陶之前的文章哦~)
一旦确定目标,接下来需要对其进行全面的验证。验证技术多种多样,虽然每种方法都是有效的,但通过多重验证的方法可以大幅增加对观察结果的信心。
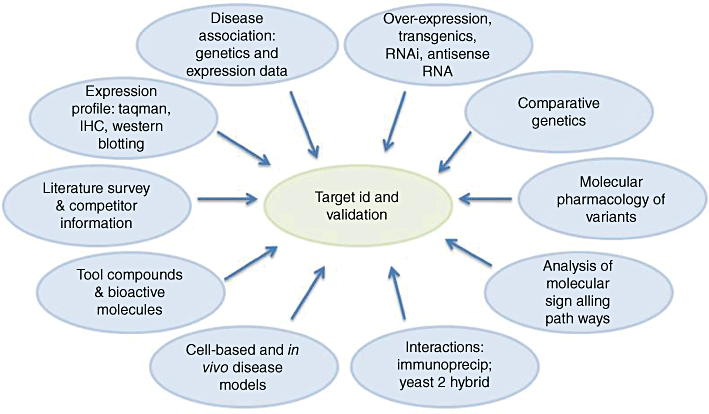
▲靶点验证
常见的方法如下:
反义技术
反义技术利用反义寡核苷酸(antisense oligonucleotides)或反义RNA(antisense RNA)来调控或抑制特定基因的表达。这种技术的基本原理是通过合成与目标基因的mRNA序列互补的反义寡核苷酸或反义RNA,从而干扰或阻止目标基因的翻译过程,使其不被转录成蛋白质。
转基因动物
转基因动物是指在其基因组中插入外源DNA的动物。这些外源DNA通常是与特定基因相关的DNA序列,可以用来研究该基因的功能。转基因动物可以通过多种方法创建,包括基因敲除、基因敲入和基因突变,是研究基因功能和疾病机制的重要工具。
siRNA靶标验证
siRNA靶标验证是一种利用小干扰RNA(siRNA)来验证潜在药物靶点的技术。在这种技术中,双链RNA(dsRNA)特异性地靶向要沉默的基因被引入到细胞或生物体中,被识别为外源遗传物质并激活RNA干扰(RNAi)途径。核酸酶蛋白Dicer被激活,结合并切割dsRNA,产生21-25个碱基对的双链片段,其中有一些未配对的悬垂末端。这些siRNA片段与靶向mRNA结合,导致其降解,从而抑制目标基因的表达。通过观察siRNA沉默后的表型,可以验证潜在药物靶点的功能。
单克隆抗体
单克隆抗体是一种极好的靶标验证工具,因为它们与靶分子表面的更大区域相互作用,甚至可以更好地区分密切相关的靶标,并且通常提供更高的亲和力。相比之下,小分子由于需要与靶标通常更保守的活性位点相互作用而处于不利地位,而可以选择抗体与独特的表位结合。这种精湛的特异性是它们缺乏非机械(或“脱靶”)毒性的基础——这是与小分子药物相比的主要优势。
化学基因组学
化学基因组学是一种系统应用工具分子进行靶标识别和验证的方法。可以定义为对化合物对基因组的反应的研究。其目标是快速识别新药物和药物靶点,包括从靶点识别和验证、化合物设计和化学合成到生物测试的多个早期药物发现技术。该方法的最终目标是提供针对基因组编码的每个蛋白质的化学工具。其目的是在对靶点进行全面投资和筛选活动之前,使用这些工具来评估细胞功能。
在靶点确认后需要进行苗头化合物(hit)的筛选。Hit是指对特定靶标或作用环节具有初步活性的化合物。发现hit的主要途径包括随机筛选的方法和理性设计的方法。理性设计的方法主要基于受体或配体结构和机制的分子设计。人工进行分子设计是一项复杂艰难,费时又烧钱的庞大工程。药物研发工作者通常会采用虚拟筛选的方式获得Hit。
进行计算机虚拟筛选有两种方式可以选择。
① 基于受体的虚拟筛选,从靶蛋白的三维结构出发,研究靶蛋白结合位点的特征性质以及它与小分子化合物之间的相互作用模式,根据与结合能相关的亲和性打分函数对蛋白和小分子化合物的结合能力进行评价,最终从大量化合物分子中挑选出结合模式比较合理的、预测得分较高的化合物,用于后续的生物活性测试。
② 基于配体的虚拟筛选,一般是利用抑制活性的小分子化合物,根据化合物的形状相似性或药效团模型在化合物数据库中搜索能够与它匹配的化学分子结构。最后对这些挑选出来的化合物进行实验筛选研究。
在Hit的基础上,通过ADMET预测分析、类药五原则,结合靶标分析阶段的文献调研和生物信息学分析所获得的信息以及生物活性验证等等,除掉大部分研发风险高的hit,可获得先导化合物(lead)。先导化合物,意为通过各种途径和手段得到的具有某种生物活性和化学结构的化合物,用于进一步的结构改造和修饰,是现代新药研究的出发点。
从先导化合物到候选药物,我们需要对先导化合物的各种缺陷通过分子对接、生物电子等排原理、前药原理等技术方法进行结构改造和修饰
总之,候选药物的研发阶段包含了创制药物的四大要素:靶标分析、检测模型、先导化合物发现和先导化合物优化。基于多学科交叉的药物分子设计是目前实现新药创制的主要途径和手段。
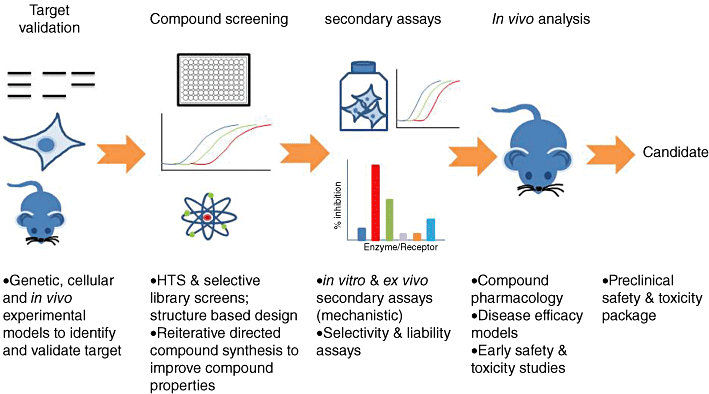
▲药物发现筛选实验概述
关于苗头化合物(Hit),先导化合物(Lead),临床前候选化合物(PCC)的区别,可查看小陶之前的回答。
苗头化合物(Hit),先导化合物(Lead),临床前候选化合物(PCC)的区别是什么?8 赞同 · 0 评论回答
即使候选物被选定,进入临床阶段的化合物流失率也很高。一般来说十个候选物中只有一个才能成功上市,在这个阶段,失败的经济后果要高得多。因此业界一直在就如何提高成功率进行激烈的讨论,目标是“快速和廉价地失败”。因为一旦候选物进入临床阶段,要终止该项目可能变得越来越困难,因为此时该项目已被公众所知,终止可能会影响公司的信誉度和价值。
所以在临床开发之前进行更多的研究,如改进的毒理学筛选(利用失败的药物来指导这些检测),建立基于深入了解疾病的预测性转化模型,以及确定生物标志物等可能有助于在临床前阶段增加药物价值,并最终有助于将更有效的药物带给患者。
[1] Hughes JP, Rees S, Kalindjian SB, Philpott KL. Principles of early drug discovery. Br J Pharmacol. 2011;162(6):1239-1249. doi:10.1111/j.1476-5381.2010.01127.x
[2] Kurosawa G, Akahori Y, Morita M, Sumitomo M, Sato N,Muramatsu C et al. (2008). Comprehensive screening for antigens overexpressed on carcinomas via isolation of human mAbs that may be therapeutic. Proc Natl Acad Sci U S A 105: 7287–7292