
2023-08-02 00:00:00来源: TargetMol小分子化合物专家浏览量:582
肺腺癌 ( LuAD ) ,是近年来每年死亡数最多的癌症之一。据统计,在美国,每天都有超过 350 人死于肺癌[1]。大量研究表明,肺癌的发生与吸烟、环境污染、电离辐射相关,但具体的病因仍不明确。近日 Nature 上一篇文章,揭示了 KRAS(G12D) 驱动一种鳞状肺腺癌的分子机制,让我们一起跟随 T 仔来看看吧~
肺泡是由单层上皮细胞构成的半球状囊泡。肺泡上皮由两种高度特化的细胞组成,分别是肺泡 1 型( alveolar type, AT1 ) 细胞和肺泡 2 型 ( AT2 ) 细胞[2]。其中,AT1 为肺泡表面主要的细胞类型,负责气体交换的功能,细胞形态呈鳞状,薄而扁平。AT2 是一种“双功能”干细胞,形态呈较小的立方形,负责产生肺表面活性物质,并且可以作为兼性祖细胞,在成人肺损伤后自我更新和再生 AT1 细胞。
肺腺癌常出现在肺的远端气体交换区域 ,其特征是具有 AT2 细胞学特征与分子特征的肿瘤细胞。 已有多项研究指出,AT2 细胞是 LuAd 的关键起源细胞,AT2 的干细胞活性由表皮生长因子受体配体 ( EGFR ) 和体内致癌性 KRAS(G12D) 选择性诱导,在小鼠体内诱导 KRAS(G12D) 后会产生腺瘤肿瘤结节[3]。
但在人类 LuAd 谱中还有一种非常良性的亚型,被称为鳞状腺癌 ( human lepidic LuAd ) ,以肿瘤细胞沿着完整的肺泡间隔非破坏性扩散为特征,其的肿瘤细胞在细胞学和分子上类似于 AT2 细胞,但目前并没有任何 LuAd 小鼠模型能够重现以鳞状方式缓慢扩张的肺泡肿瘤,这种良性表型细胞的起源和分子机制仍不明确。
2023 年 7 月 19 日,来自斯坦福大学的研究团队在 Nature 发文 KRAS(G12D) drives lepidic adenocarcinoma through stem-cell reprogramming ,揭示了 KRAS(G12D) 通过将分化的 AT1 细胞重新编程回 AT2 干细胞,从而生成惰性肿瘤的过程。

https://www.nature.com/articles/s41586-023-06324-w
鉴于鳞状腺癌与其他 LuAd 亚型重叠的突变谱以及其独特的生物学特性,作者认为鳞状腺癌的起源应该并非 AT2 细胞。而 AT1 细胞作为唯一的另一种肺泡上皮细胞类型,引起了作者的注意。但通常而言, AT1 细胞被认为是终末分化的,并且在整个生命过程中由 AT2 干细胞再生而来。因此,可能存在一种促进 AT1 细胞去分化重编程的机制,比如 LuAd 中常见的致癌基因突变 —— KRAS (G12D)。
研究通过基因改造,靶向诱导小鼠 AT1 细胞中 KRAS(G12D) 的表达。 6 个月后观察到不同程度的介于鳞状和立方体形态之间的细胞。单细胞 RNA 测序 ( scRNA-seq ) 结果也显示, 相当一部分 AT1 细胞在 KRAS(G12D) 的诱导下会逐渐丧失 AT1 细胞的分子表型,被重编程为 AT2 细胞 ( iAT2 ) 。并且重编程的 iAT2 细胞在转录组学上与正常的 AT2 细胞非常相似,大部分还具有增殖所必须的WNT活性。但同时也存在一些并不会被 KRAS(G12D) 诱导影响的 AT1 细胞。
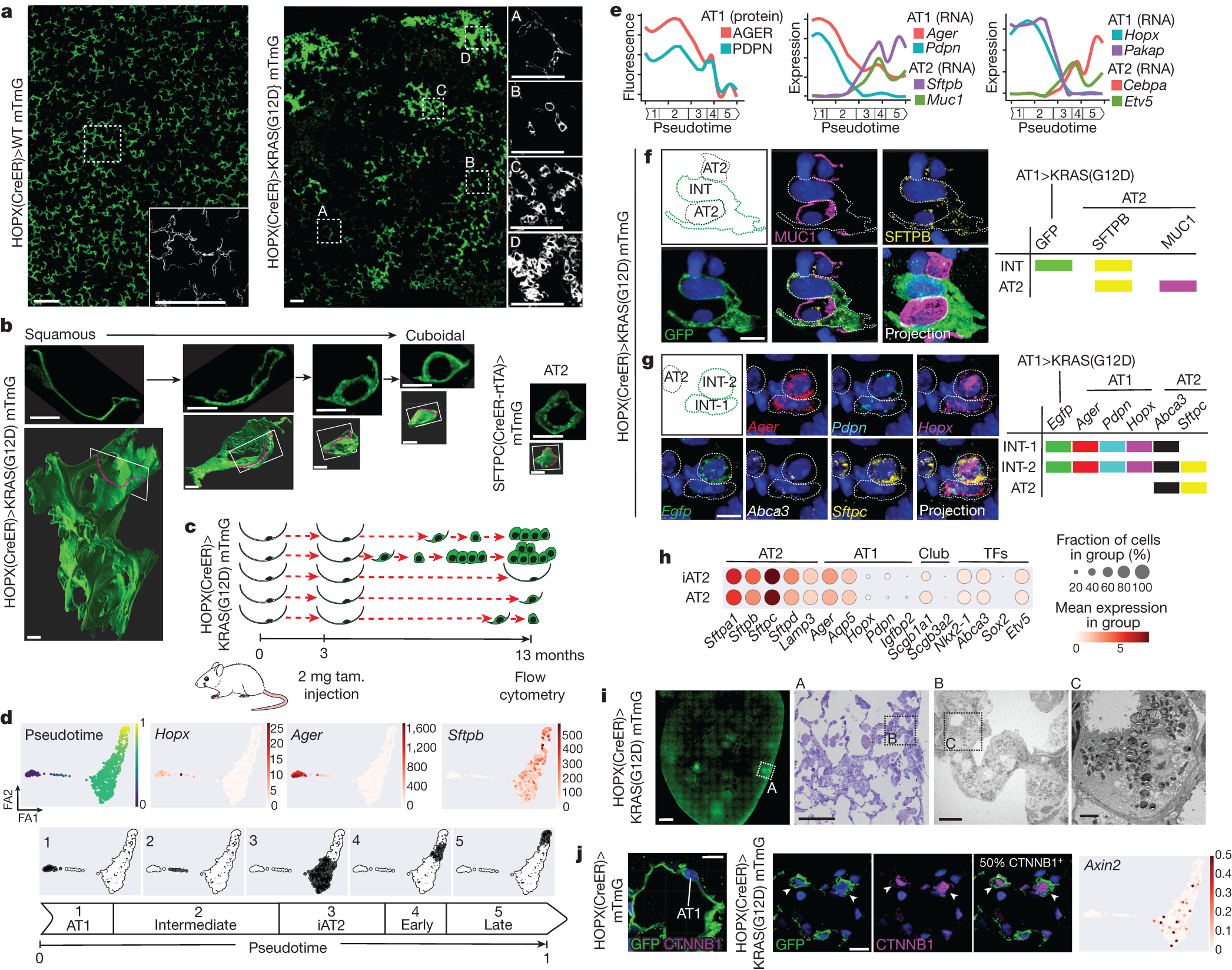
KRAS(G12D) 将 AT1 细胞异步重编程为 AT2 干细胞
相较具有干细胞活性的 AT2 而言, AT1 细胞中 KRAS(G12D) 的表达具有较弱的致癌性,6 个月的诱导表达也仅产生贴壁的腺瘤或是结节,这可能也解释了为何 AT1 细胞来源的这种鳞状腺癌为何具有更良性的表型。
在 AT1 和 AT2 两种来源的肿瘤细胞中,下游丝裂原激活蛋白激酶 (MAPK) 通路的 JNK 通路无显著差异,均具有较高的活性,但 AT1 驱动的癌细胞中 ERK 通路的磷酸化程度显著更低。提示了我们 JNK 通路在 KRAS 激活 AT1 细胞中的重要作用。
进一步的实验发现,在 KRAS(G12D) 和 WT KRAS 小鼠 AT1 表型 (NKX2-1+ LAMP3- ) 细胞中, pJUN 染色也没有差异。这说明了 KRAS(G12D) 下游 MAPK 激活的失败可能是部分 AT1 细胞未能重编程为 AT2 细胞的原因所在。
与此同时,AT1 和 AT2 两种来源的肿瘤细胞对于 WNT 的激活也显示出截然不同的反应。在 AT1 细胞中 WNT 的激活对 ERK 活性并无影响,并且会降低 JNK 活性,使得与腺瘤生长相关的 MAPK 总活性较低,起到抗肿瘤生长的作用。在 AT2 细胞中 WNT 的激活会显著增加 ERK 活性,降低 JNK 活性,驱动腺瘤的增殖生长。
这表明, ERK 通路的激活可能是 AT1 腺瘤进展的关键驱动因素。在给予 KRAS(G12D) 诱导 AT1 细胞1 周的小鼠含有 PLX4720 (ERK 信号传导激动剂)、PD0325901 (MEK1/2 抑制剂(ERK 直接上游))或不含添加剂的饲料 11 周后,染色结果证实腺瘤数量和大小与 ERK 活性水平密切相关。 ERK 通路激活不仅促进了 AT1 细胞的腺瘤转化,还驱动了肿瘤的生长和组织学进展。
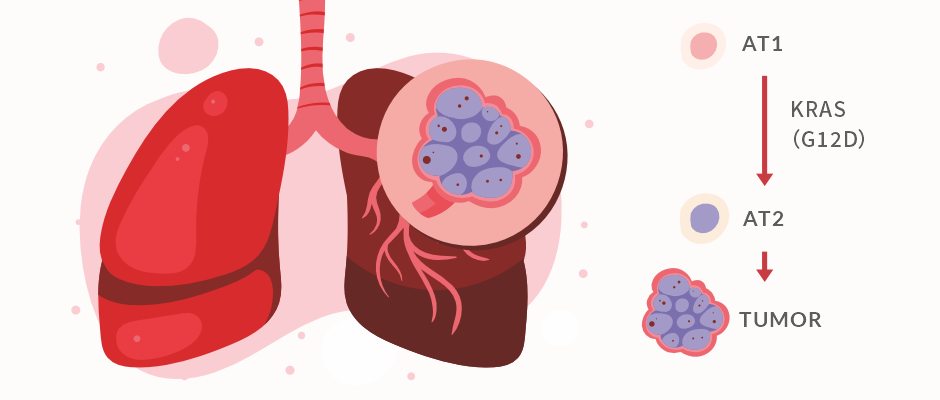
综上,本研究鉴定出了一种新的肺腺癌起源细胞,AT1 细胞。在小鼠肺中, AT1 细胞会被 KRAS(G12D) 驱动重编程为 AT2 细胞,并且激活 MAPK 信号通路,生成惰性肿瘤。提示我们针对 KRAS(G12D) 靶点以及 MAPK 信号通路的药物开发可能是肺腺癌治疗非常有前景的新方向。
科研助力
当下,KRAS 相关研究依旧如火如荼,TargetMol® 可为您提供 MAPK 抑制剂库,助力您的科研需求。欢迎点击下方产品跳转产品页查看,如感兴趣或有疑问可私聊 T 仔咨询噢~

https://www.targetmol.cn/compound-library/MAPK_Inhibitor_Library
MAPK 是信号从细胞表面传导到细胞核内部的重要传递者。丝裂原活化蛋白激酶 (MAPK) 是一组能被不同的细胞外刺激活化的蛋白激酶,如细胞因子、神经递质、激素、细胞应激及细胞黏附等。MAPK 链是真核生物信号传递网络中的重要途径之一,在基因表达调控和细胞质功能活动中发挥关键作用。共同调节着细胞的生长、分化、对环境的应激适应、炎症反应等多种重要的细胞生理和病理过程。
TargetMol MAPK 抑制剂库是有367个MAPK信号通路相关的小分子的集合,用于研究MAPK信号通路及相关疾病药物筛选。
参考文献:
[2] Hogan, B.L., Barkauskas, C.E., Chapman, H.A., Epstein, J.A., Jain, R., Hsia, C.C., Niklason, L., Calle, E., Le, A., Randell, S.H., et al. (2014). Repair and regeneration of the respiratory system: complexity, plasticity, and mechanisms of lung stem cell function.Cell Stem Cell 15, 123–138.
[3]Desai TJ, Brownfield DG, Krasnow MA. Alveolar progenitor and stem cells in lung development, renewal and cancer. Nature. 2014;507(7491):190-194. doi:10.1038/nature12930
[4] Juul NH, Yoon JK, Martinez MC, et al. KRAS(G12D) drives lepidic adenocarcinoma through stem-cell reprogramming [published online ahead of print, 2023 Jul 19]. Nature. 2023;10.1038/s41586-023-06324-w. doi:10.1038/s41586-023-06324-w