抗生素的使用是医学史上的重大革命之一,为多种曾经致命的传染病提供了有效的治疗。但随着现代医学中抗生素的广泛应用,病原体的耐药性也逐渐成为棘手的问题。因此,新一代的抗生素开发刻不容缓。
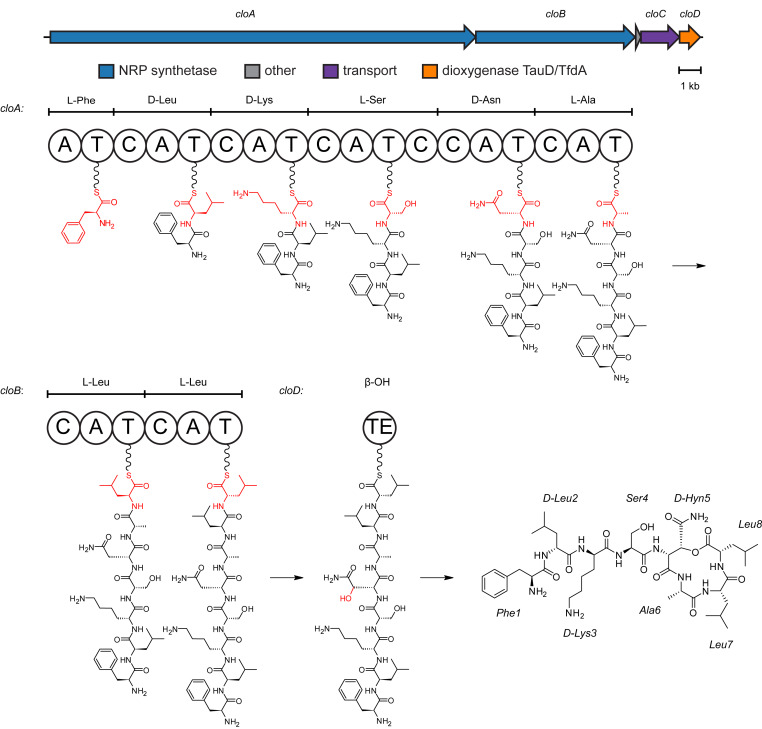
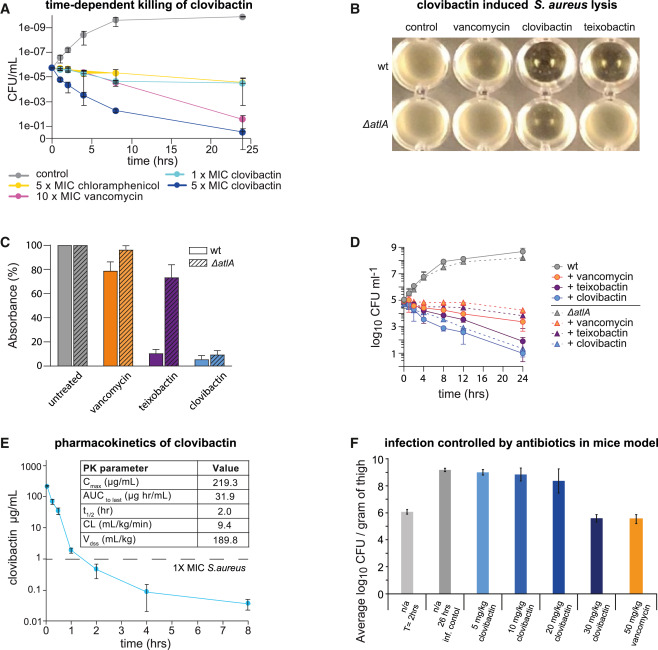
2023 年 8 月 22 日,来自荷兰乌得勒支大学的研究团队在 Cell 发文: An antibiotic from an uncultured bacterium binds to an immutable target ,从未培养的土壤细菌中分离得到一种新的抗生素 Clovibactin ,对多种耐药革兰氏阳性菌具有抗菌活性,让我们一起跟随 T 仔来看看吧~当前临床上使用的抗生素大多源自土壤细菌中筛选而来的天然产物骨架。然而由于不同菌种生长环境的特殊性,仍有 99% 的菌种并未在实验室中被培养。本研究中,作者把目光瞄向了一些需要长时间孵育才能在体外开始生长的环境细菌以及孢子。在孵育 12 周后,通过黄金色葡萄球菌营养琼脂平板筛选得到一株具有显著抑菌作用的菌株。因其 16S rDNA 序列与 E. terrae 的相似性高达 99% ,作者将该分离株命名为 E. terrae ssp. carolina 。由于 E. terrae 是一种“未培养”细菌,无法通过常规方法回收,作者决定对 E. terrae ssp. carolina 提取物中的抗菌化学成分进行鉴定。通过高效液相色谱 ( HPLC ) 分离得到一种 Antibase 数据库中未有记录的化合物组分,质量为 903.5291 [M+H]+。质谱和液体核磁共振 ( NMR ) 解析发现,该化合物是一种新型的缩酚酞,并将其命名为 Clovibactin 。进一步的,作者对 E. terrae ssp. carolina 进行了全基因组测序,定位到一段与 Clovibactin 合成相关的基因簇,包含两个非核糖体肽合酶 ( NRPS ) 基因 ( cloA和cloB )、一个转运蛋白基因 ( cloC ) 和一个裁剪酶 ( cloD ) ,并提出了 Clovibactin 的生物合成途径。▲ Clovibactin 的生物合成基因簇和拟议的生物合成途径Clovibactin 对多种耐药性的革兰氏阳性病原体都具有抗菌活性,包括 耐甲氧西林金黄色葡萄球菌 ( MRSA ) 、耐达托霉素和中度耐万古霉素金黄色葡萄球菌 ( VISA ) 菌株以及难以治疗的耐万古霉素肠球菌粪肠球菌和粪肠球菌( 耐万古霉素肠球菌 [VRE] )。与万古霉素相比,Clovibactin 能够更有效的杀死金黄色葡萄球菌,最低杀菌浓度 ( MBC ) 为 2 × MIC(最低抑菌浓度)。
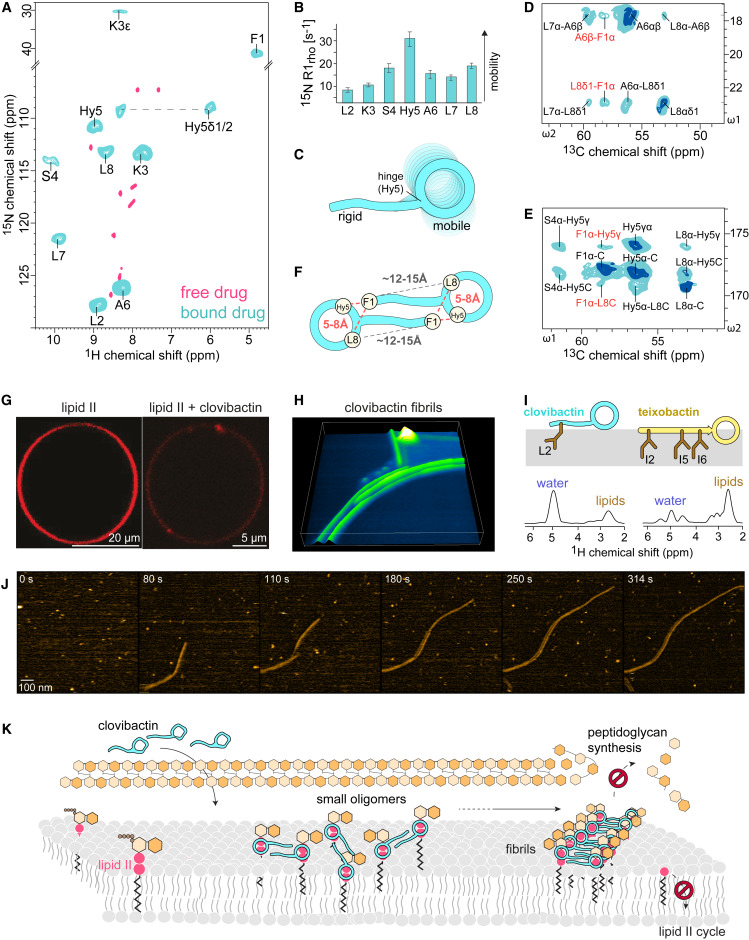
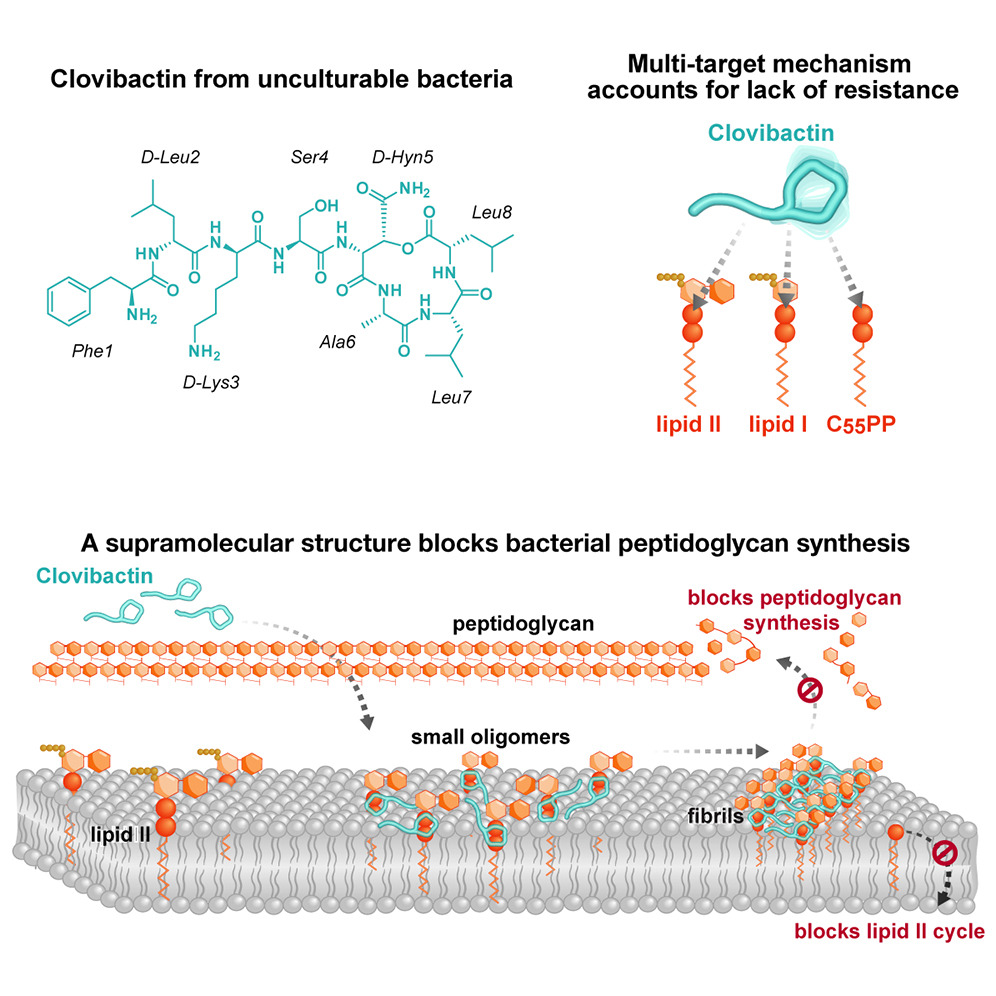
▲Clovibactin 体外和体内杀灭金黄色葡萄球菌在实验过程中,作者注意到,Clovibactin 对细胞具有很强的降解能力。通过对金黄色葡萄球菌主要生物合成途径(DNA、RNA、蛋白质和肽聚糖)前体进行标记后发现,Clovibactin 特异性干扰放射性标记 N -乙酰氨基葡萄糖 ( GlcNAc ) 掺入细胞壁,抑制 肽聚糖 ( PGN ) 和壁磷壁酸 ( WTA ) 合成的膜相关步骤,干扰细胞壁的合成,导致细胞裂解。基于 liaI-lux 诱导监测以及细胞荧光染色的结果,作者缩小了细胞壁生物合成途径内分子靶标的范围。Clovibactin 主要通过靶向 十一异戊二烯焦磷酸 ( C 55 PP ) 、脂质 II 以及脂质 III WTA 等多种参与细胞壁生物合成的底物的 焦磷酸 ( PPi ) 基团,形成超分子结构的小寡聚物,组装成的原纤维,稳定结合脂质,从而阻断病原体细胞壁的生物合成,起到杀菌作用。并且由于该靶点的低变异性与在细菌膜外的特异性分布,使得 Clovibactin 更不易被耐药,并具有较低的细胞毒性。▲ Clovibactin -脂质 II 复合物在膜中的 ssNMR 结构模型和寡聚综上,本研究在未培养的土壤微生物中筛选提取到一种具有良好革兰氏阳性耐药菌抗菌活性的抗生素 Clovibactin,独特的作用靶点使其具有良好的选择性,且更不易耐药。期待 Clovibactin 作为先导化合物,在耐药菌抗生素的开发中起到关键的指导作用~当下,抗生素相关研究依旧如火如荼,文中的 Clovibactin 产品 TargetMol® 正在加急研发合成中,欢迎公众号私信或联系当地销售跟进最新进度。此外 TargetMol® 还可为您提供抗生素库、抗感染天然产物库以及 Mini 真菌代谢天然产物筛选库,助力您靶向 抗生素后续的新药研发工作。欢迎点击下方产品跳转产品页查看,如感兴趣或有疑问可私聊 T 仔咨询噢~[1] Shukla R, Peoples AJ, Ludwig KC, et al. An antibiotic from an uncultured bacterium binds to an immutable target [published online ahead of print, 2023 Aug 16]. Cell. 2023;S0092-8674(23)00853-X. doi:10.1016/j.cell.2023.07.038