
2023-09-21 00:00:00来源:Science浏览量:472
阿尔茨海默病(AD)是一种神经退行性疾病,随着疾病的进展,患者大脑中的神经元会逐渐退化和死亡,进而导致记忆力和认知能力逐渐下降。然而,神经元丢失的潜在机制至今仍不清楚。
近日,一项发表在Science杂志上的研究揭示了与神经元死亡密切相关的关键因素——一种名为MEG3的长链非编码 RNA 基因可诱导人类神经元程序性坏死(necroptosis)。这一发现给 AD 的进展过程带来了新视角,为未来开发新的疗法提供了新的研究方向和潜在治疗途径。

▲点击图片可跳转原文
在这项研究中,研究人员创建了一个 新模型,将健康的人类和小鼠神经元植入 AD 小鼠模型的大脑中,以研究它们在大脑老化过程中的变化。
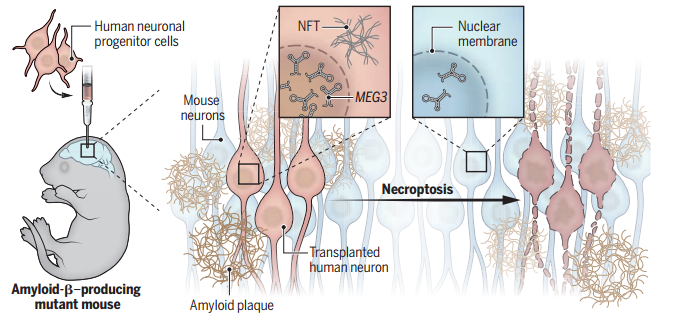
研究人员在移植到小鼠 AD 模型大脑中的人类和小鼠神经元中分离出转录组,并进行了测序。结果发现,只有人类神经元表现出 AD 的典型病理特征,包括神经纤维缠结(NFTs)、颗粒囊性神经变性(GVD)、磷酸化 Tau 血液生物标志物和显著的神经元细胞丧失。同时,异种移植的神经元发生了程序性坏死,约有 50% 异种移植的人类神经元在 Aβ 小鼠中死亡。
对于神经元死亡的原因,研究人员并未观察到与细胞凋亡有关的基因表达变化,但发现编码程序性坏死执行蛋白的基因 MLKL 和 RIPK3 显著上调。
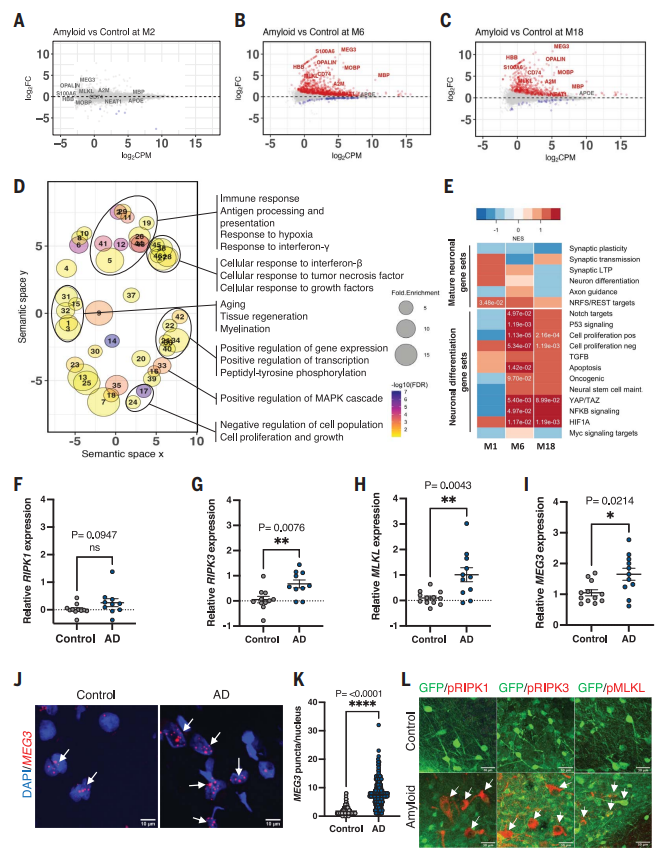
▲异种移植神经元的转录变化
既然神经元细胞的丧失主要是由程序性坏死引起的,那么,又是什么驱动着神经元程序性坏死呢?研究人员在异种移植的人类神经元中发现了数十个表达改变的长链非编码 RNA,其中 上调最显著的 MEG3引起了研究人员的注意。
MEG3 是一种长链非编码 RNA,参与调控细胞死亡途径。尽管在过去未被认为与阿尔茨海默病(AD)相关,但研究人员在数据库中发现,AD 患者的大脑中也存在 MEG3 上调的现象,并且通过 qPCR 验证,发现在从 AD 患者的颞叶提取的 RNA 中,MEG3 的表达上调 了2-3 倍。
体外实验也显示,MEG3 表达可以通过激活细胞程序性坏死途径标志物(包括pRIPK1、pRIPK3 和 pMLKL)诱导人类神经元细胞死亡。
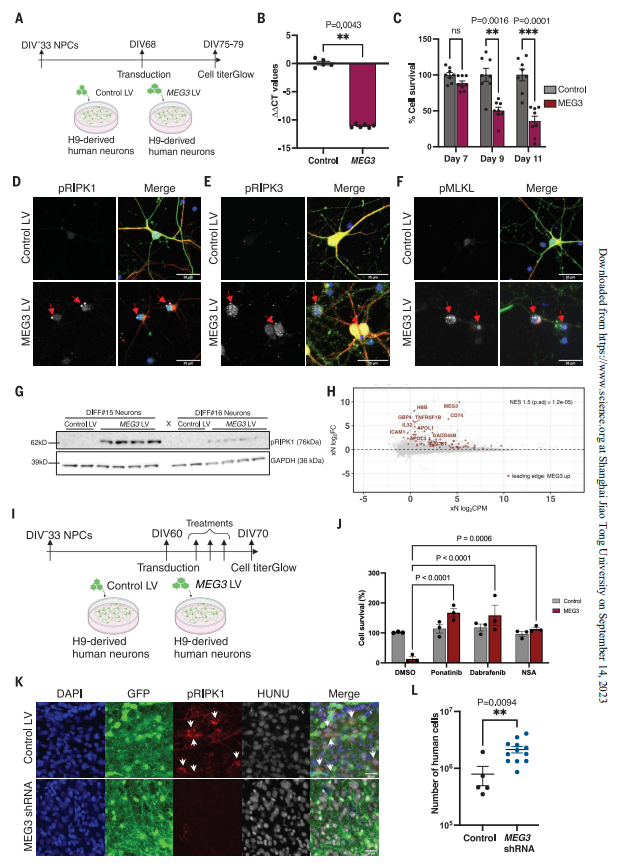
▲长链非编码RNA MEG3 诱导人类神经元程序性坏死
进一步,研究人员还对接受异种移植的小鼠进行了 ponatinib 和 dabrafenib 坏死程序激酶抑制剂治疗。它们发现,与未经处理的小鼠相比,治疗组中的 pRIPK1、pRIPK3 和 pMLKL 水平显著下降。神经细胞数量的 qPCR 分析显示,与对照组相比,治疗组中的 神经元数量显著增加。此外,进一步的研究还揭示了 RIPK3 基因的敲除对神经元的存活具有改善作用,并且在 缺乏 RIPK3 的人类神经元中,坏死信号显著减少。
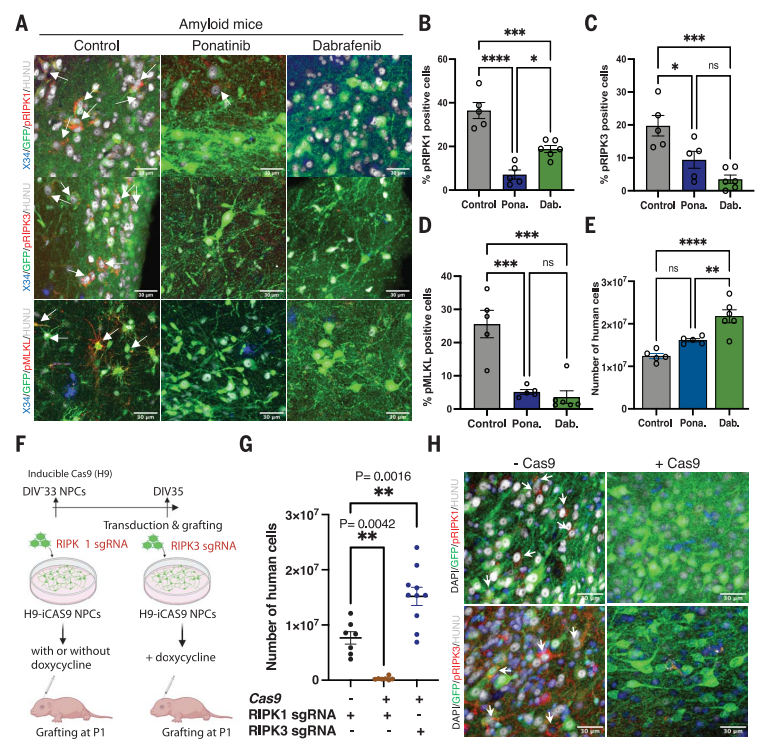
▲抑制坏死可防止人类神经细胞丧失
也就是说,通过药物或基因介入受体相互作蛋白激酶(RIPK1、RIPK3)或混合线粒体激酶结构域样蛋白(MLKL),可以抑制程序性坏死,从而挽救异种移植的人类神经元的丧失。因此,研究人员认为,MEG3 可能通过促进程序性坏死途径来促进阿尔茨海默病的发病机制。
总之,这项研究使用了人类或小鼠神经元,并将它们移植到 AD 小鼠模型的大脑中。研究结果表明,只有人类神经元显示了与阿尔茨海默病(AD)相关的缠结、颗粒囊泡神经退行性变(GVD)、磷酸化 tau 血液生物标志物以及显著的神经元丧失。此外,长链非编码 RNA MEG3 的单独表达已被证明足以在体外诱导人类神经元坏死。通过降低 MEG3 的表达并采用药物或基因干预措施来抑制受体相互作蛋白激酶 RIPK1、RIPK3 或混合线粒体激酶结构域样蛋白(MLKL),成功拯救了异种移植的人类神经元的细胞丧失。这项研究为我们提供了关于 AD 分子机制的新见解,同时为开发 AD 的新治疗方法奠定了理论基础。
神经退行性疾病是机体神经元结构或功能逐渐丧失而引发的一类疾病。陶术可提供 神经退行性疾病化合物库、抗阿尔茨海默症化合物库、RNA靶向化合物库以及激酶抑制剂库等化合物库,助力您神经退行性疾病相关的靶点鉴定和药物研发,欢迎私信咨询~
参考资料:
[1] Sriram Balusu et al. ,MEG3 activates necroptosis in human neuron xenografts modeling Alzheimer’s disease.Science381,1176-1182(2023).DOI:10.1126/science.abp9556
[2] Daniel W. Sirkis Jennifer S. Yokoyama ,Role for cell death pathway in Alzheimer’s disease.Science381,1156-1157(2023).DOI:10.1126/science.adk2009