
2023-09-27 00:00:00来源:普利制药浏览量:561
多重因素共同推动药品出海加速
药品扬帆出海已成为趋势:中国医药管理协会数据显示,2021年国内企业向美国FDA申报新药IND近百个,中外同步申报的新药增多;28家国内企业的65个仿制药品种获美国FDA的ANDA,其中近一半为注射剂,其均显示我国的新药和仿制药国际化之路迈出实质步伐。
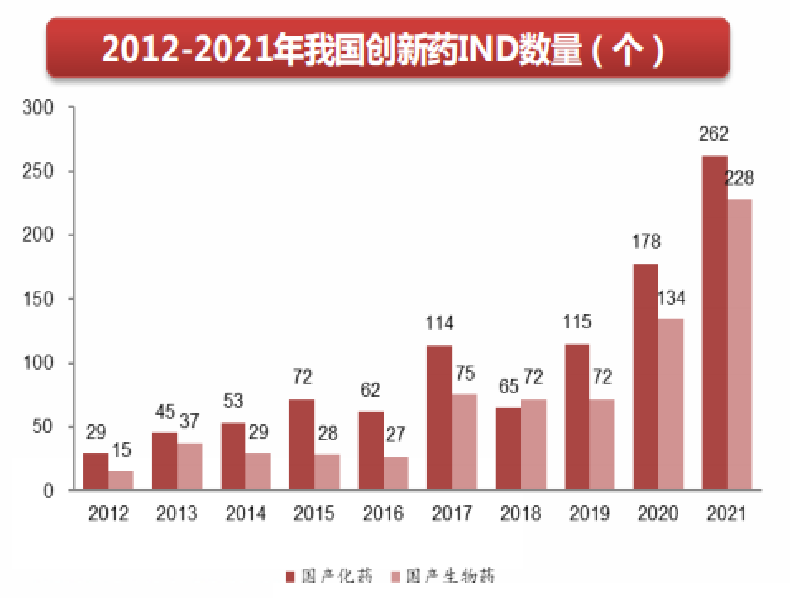
药品扬帆出海加速原因,主要包括以下几个方面:(1)集采政策影响:集采带来的销量增长并不能抵消价格下降带来的收入降低,“价跌量平”、甚至“量价双杀”,企业可能转而寻求出海;(2)医保谈判影响:纳入医保药品价格大幅下降,同时医保目录谈判新药的覆盖比重逐渐加大,迫于价格与产品的“双内卷”,或因生存倒推,本土创新药企“出海”速度加快;(3)国内产能过剩:我国仿制药产能已经明显过剩,加上集采等因素影响,很多产品的利润被腰斩,倒逼企业选择出口;(4)一带一路政策推进:新兴市场国家具有广大的医药市场潜力和未满足的临床需求,加速推动我国医药创新产品“走出去”。
美国是全球最大药品市场,中美双报是出海重要策略
根据EFPIA相关数据,从全球市场份额角度来看,北美市场占据全球药品市场40%左右,欧洲市场占约22%,中国作为新兴医药市场的领头羊,占全球药品市场规模比重约20%,日本占约8%,其他国家市场约占全球药品市场的10%。

随着中国加入ICH并成为ICH管理委员会成员,中国制药正加速与国际接轨。在中美开放临床数据互认的前提下,对大多数中国药企而言,越早进行“中美双报”或多国多地注册,越有利于提升药品上市速度,尽早获取中美或多国多地的市场,也有利于研发效率的提升。美国作为支付能力最强、新药监管水平最高的国家之一,进入美国市场也就意味着打开了国际化的大门。目前,按照 FDA 的标准研发和申报新药已经成为中国新药开发的新趋势。
中美双报的主要挑战
(1)对FDA药品申报法规理解不足:中美药品申报相关法规存在差异,深入理解相应法规是药品申报的重要基础。

美国FDA新药申请
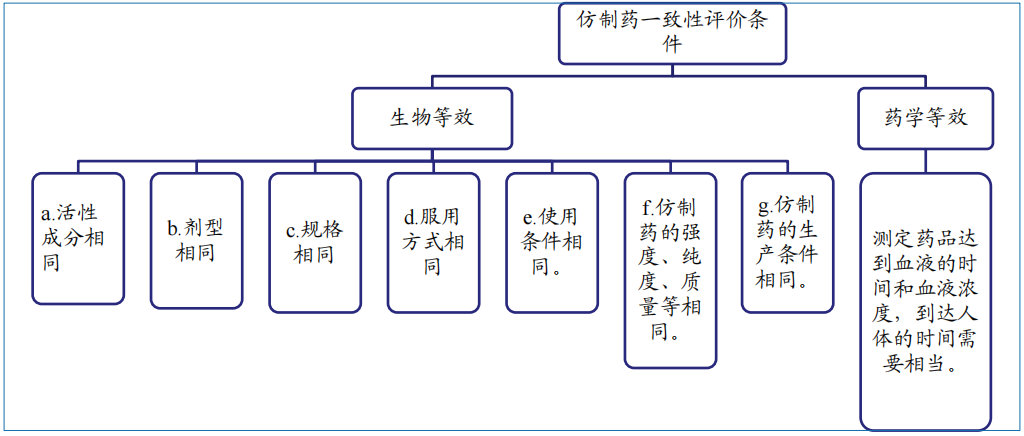
美国FDA仿制药申请
(2)生产线及质量体系不符合FDA要求:欧美标准体系与国内不同,生产线维护成本高,而国内多数厂家生产线并未通过FDA认证,生产车间和质量体系较难符合FDA要求。
合作研发、申报、生产,药品出海快人一步
目前药品出海趋势已经形成,面对自身对FDA申报法规理解不透彻、没有满足FDA需求的生产场地,或许将药品研发、申报、生产工作委托给目前具有相关实力的企业来做,是一种捷径。
国内已有较多企业有成功申报FDA并上市销售的企业案例,例如普利制药,目前已有多个剂型通过FDA认证,包括冻干、水针、片剂、胶囊、干混悬剂,另外滴眼剂、预充针、口服液等生产线也将通过FDA认证,美国获批并商业化产品超过20个。
