2025-07-02 11:50:38来源: 注册圈浏览量:1230
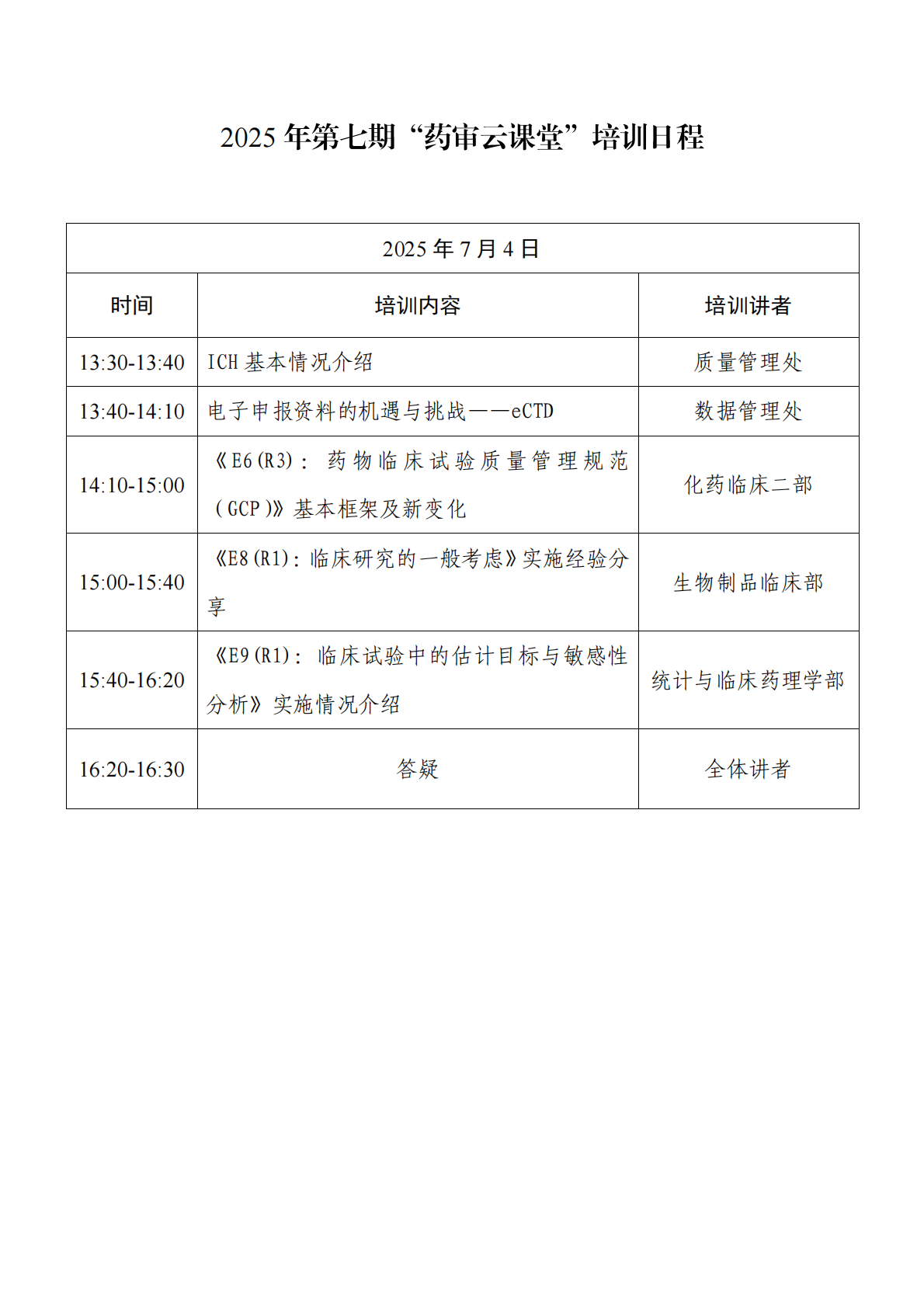
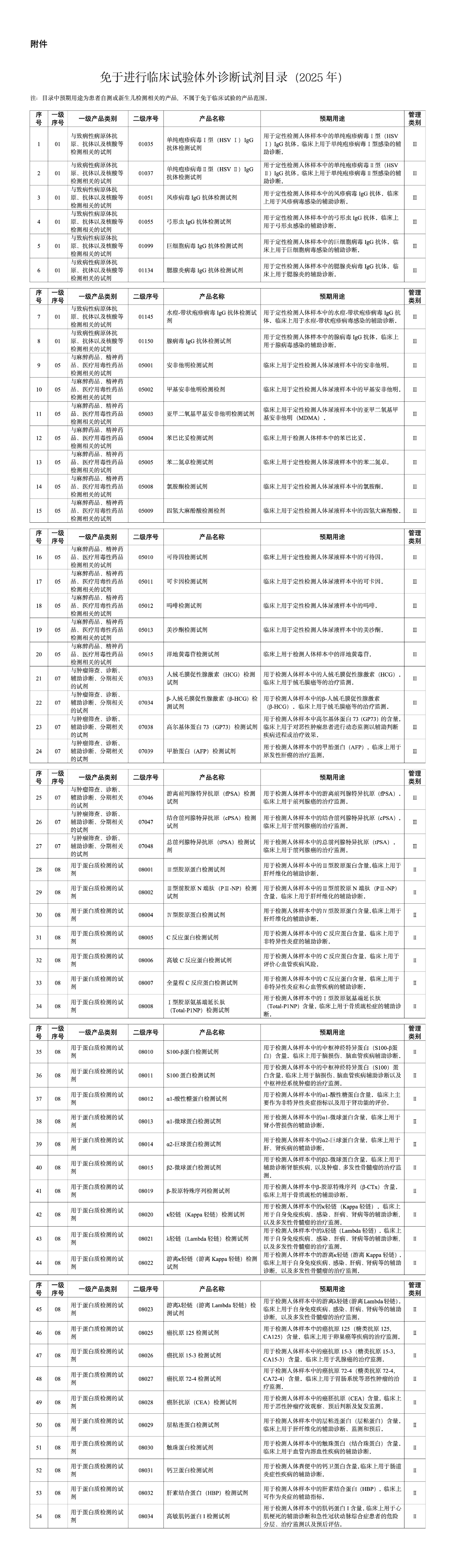
一、2025年第七期“药审云课堂”培训报名通知 网址: https://www.cde.org.cn/main/news/viewInfoCommon/25df3ca1b60384c179f161866fcc0d1f 我中心定于7月4日13:30-16:30举办2025年第七期“药审云课堂”。本期课程将对ICH及相关指导原则内容进行解读。现将有关事宜通知如下: 一、培训内容 (一)培训主题 ICH《E6(R3):药物临床试验质量管理规范(GCP)》《E8(R1):临床研究的一般考虑》《E9(R1):临床试验中的估计目标与敏感性分析》指导原则是ICH发布的药物临床试验领域关键指导原则。其中,E6(R3)指导原则于2025年1月在ICH官网正式发布,本期云课堂拟邀请EWG专家围绕新版GCP指导原则的基本框架及新变化进行解读,以期提升监管机构和业界人员对E6(R3)指导原则的理解和掌握;E8(R1)和E9(R1)指导原则已在国内落地实施多年,此次旨在围绕其实施经验、监管机构和业界共同关注的问题进行介绍。同时,为更好帮助申请人了解并更好使用eCTD ,此次将从电子申报资料的机遇与挑战的角度切入,深入讲解eCTD的相关内容,并鼓励申请人。 (二)答疑互动:培训前期可以登录 “药审云课堂平台”——“云课堂提问与互动”对相应主题进行提问,培训过程中也将在直播互动区进行适时的问题收集,在答疑环节对其中的共性问题进行集中解答。 二、培训时间 2025年7月4日,13:30-16:30 (一)采用在线平台进行线上直播。 (二)可点击药审云课堂平台“药审云课堂直播入口”观看。 四、参加人员 培训面向全社会公开,欢迎药品监管机构、研发企业、药品生产企业的注册及研发相关人员参加。 五、报名注册 (一)此次培训不收取费用,参与人员扫描二维码进入注册即可。 二维码: 报名链接: https://urlisqvzb.vzan.com/live/page/1202606004?v=1750075494330 (二)请参与培训的人员注册后提交与本课程相关的问题。 (三)欢迎通过药审云课堂平台“云课堂提问与互动”提出培训需求和主题建议。 附件: 1.2025年第七期“药审云课堂”培训日程 2.在线报名观看流程 https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20250624112000177.html 特此通告。 附件:免于进行临床试验体外诊断试剂目录(2025年) 国家药监局 2025年6月23日 https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20250625095031160.html https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxhybzhgg/20250625151905183.html 国家药监局 2025年6月18日 https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20250625160217110.html 根据《处方药与非处方药分类管理办法(试行)》(原国家药品监督管理局令第10号)规定,经国家药监局组织论证和审核,抗感解毒片和舒筋活络止痛膏由处方药转换为非处方药。品种名单(见附件1)及非处方药说明书范本(见附件2)一并发布。 附件: 1.品种名单 国家药监局 2025年6月20日 (一)关于花生红衣等中药饮片炮制规范草案的公示 网址: http://mpa.shandong.gov.cn/col/col101747/art/2025/art_ed87102a908c45d584084c95ab7d9b41.html 根据《山东省中药材标准》《山东省中药饮片炮制规范》制修订工作安排,为确保标准的科学性、合理性和适用性,现将制订的花生红衣等3个饮片炮制规范草案公示征求意见,公示期自发布之日起30日。请相关单位认真研核,若有异议,请及时来函提交反馈意见,并附实验数据及相关说明。反馈来函需加盖公章,并同时发送电子材料至指定邮箱,期满未回函视为无异议。 联系人:汪冰 牛艳 联系电话:0531-81216521 0531-81216522 电子信箱:sdyjzyk@163.com 联系地址:山东省食品药品检验研究院,济南市高新区新泺大街2749号 邮编:250101 附件:花生红衣等饮片炮制规范公示稿.ra 2025年6月26日 二、浙江省药品监督管理局 (一)浙江省药品监督管理局关于实施2025年版《中华人民共和国药典》有关事宜的通知 网址: https://mpa.zj.gov.cn/art/2025/6/24/art_1228989285_58940963.html 各药品上市许可持有人、药品生产企业,各有关单位: 2025年版《中华人民共和国药典》(以下简称《中国药典》)已由国家药监局、国家卫生健康委2025年第29号公告颁布,自2025年10月1日起实施。国家药监局于2025年3月25日发布了关于实施2025年版《中国药典》有关事宜的公告(2025年第32号)。根据上述公告要求,结合我省实际,现就实施2025年版《中国药典》有关事宜通知下: 一、各药品上市许可持有人、药品生产企业要按照国家药监局2025年第32号公告要求,参照国家药典委员会关于2025年版《中国药典》实施有关问题的解答意见,切实做好药典标准的实施工作。 二、各药品上市许可持有人、药品生产企业应对全品种、全门类(包括但不限于原料药、辅料、直接接触药品的包装材料、药材、饮片等)进行系统梳理,对照新旧版本《中国药典》,逐一对标准的变化情况进行研究,重点关注相关通用技术要求等内容,确保产品符合2025年版《中国药典》要求。对于需要变更药品注册标准的,各药品上市许可持有人和药品生产企业应当在2025年版《中国药典》实施之日前,按照药品上市后变更管理相关规定提出补充申请、备案或者报告,并按要求执行。 三、对于以下情形,仅涉及药品说明书和标签中【执行标准】项内容变更的,按《药品说明书和标签管理规定》等要求自行修订药品说明书和标签中【执行标准】项内容,修订日期以企业内部质量管理记录载明的日期为准,无需向省药监局申请备案。各药品上市许可持有人和药品生产企业对药品说明书和标签内容的真实性、合法性负责。 (一)原收载于历版药典、局(部)颁标准,现执行2025年版《中国药典》标准的。 (二)原执行药品注册标准或同时执行2020年版《中国药典》标准和药品注册标准,各药品生产企业开展与2025年版《中国药典》标准对比研究工作后,执行2025年版《中国药典》标准或同时执行2025年版《中国药典》标准和药品注册标准。 (三)注册标准变更获批准或完成备案,按补充申请批准通知书或备案内容变更说明书、标签相关内容的。 对长期未生产的品种,应在恢复生产前完成有关工作。 五、自2025年版《中国药典》实施之日起,凡原执行浙江省中药炮制规范、浙江省中药材标准的品种,2025年版《中国药典》已收载的,应当执行2025年版《中国药典》,相应浙江省中药炮制规范、浙江省中药材标准停止执行;2025年版《中国药典》未收载的,仍执行相应浙江省中药炮制规范、浙江省中药材标准,但应当符合2025年版《中国药典》的相关通用技术要求。浙江省医疗机构制剂应当符合2025年版《中国药典》的相关要求。 六、各药品上市许可持有人、药品生产企业及有关单位应认真做好2025年版《中国药典》的贯彻实施工作,执行中发现问题,及时向省药监局药品注册与监测评估处反馈。 浙江省药品监督管理局 2025年6月23日 (二)关于发布《浙江省医疗机构应用传统工艺配制中药制剂备案入市第一课》和《浙江省医疗机构应用传统工艺配制中药制剂备案指南》的通知 网址: https://mpa.zj.gov.cn/art/2025/6/27/art_1228989285_58941003.html 各有关单位: 为进一步规范医疗机构应用传统工艺配制中药制剂备案管理工作,根据《中华人民共和国中医药法》等相关规定,浙江省药品化妆品审评中心制定了《浙江省医疗机构应用传统工艺配制中药制剂备案入市第一课》《浙江省医疗机构应用传统工艺配制中药制剂备案指南》,现予以发布。 附件: 1.浙江省医疗机构应用传统工艺配制中药制剂备案入市第一课 传统中药制剂备案法规文件资料包 2.浙江省医疗机构应用传统工艺配制中药制剂备案指南.pdf 浙江省药品化妆品审评中心 三、北京市药品监督管理局 新增3个共性问题 网址: https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/bjah-index-dept!detail.action?originalId=AH25062201172 (一)中药饮片假药劣药如何判断 (二)北京地区药品营业执照和药品经营许可证地址不一致咨询 (三)药品认定
三、培训方式




特此公告。
请相关药品上市许可持有人于2026年3月19日前,依据《药品注册管理办法》(国家市场监督管理总局令第27号)等有关规定,就修订说明书事项向省级药品监督管理部门备案,并将说明书修订的内容及时通知相关医疗机构、药品经营企业等单位。
非处方药说明书范本规定内容之外的说明书其他内容,按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。自补充申请备案之日起生产的药品,不得继续使用原药品说明书。
特此公告。
2.非处方药说明书范本
山东省药品监督管理局