
2025-08-08 10:43:10来源:鼎泰集团TriApex浏览量:660
药物引起的光毒性反应是一种常见但报道较少的不良反应,近年来,随着药物开发类型的丰富和在临床使用过程中光毒性反应的不断发现,光安全性的关注度逐步提高。本文将结合 ICH S10 指导原则、有关文献以及鼎泰团队的丰富项目经验,对现行的非临床光安全性评价关注点以及结合相关案例对其评价策略进行归纳总结。
全文共:5659 字 10 图
预计阅读时长:20 分钟
★ 文章导览 ★
01 | 光毒性作用机制 |
02 | 触发光安全性评价的条件 |
03 | 体外光安全性评价 |
04 | 体内光安全性评价 4.1 实验动物的选择 4.2 辐射条件的选择 4.3 试验周期和剂量的设计 4.4 检测指标 |
05 | 体内外光安全性评价案例分析 案例1 Ceritinib(Zykadia®) 案例2 DS-8201(Enhertu®) |
06 | 结语 |
光毒性作用机制
光毒性是指由光诱导的,组织对光反应化合物的急性反应。药物引起的光毒性与药物剂量、暴露于紫外线的程度、紫外线的类型以及足够的皮肤分布体积等相关。
光毒性作用机制的三个关键途径
单电子转移路径:单个电子可传递给活化的光敏剂,直接引发自由基形成并单独导致细胞损伤;或自由基进一步与氧气反应,生成羟基自由基(·OH)或过氧自由基(ROO·)
能量转移路径:活化的光敏剂将能量转移给氧气,形成单线态氧(¹O₂),该活性氧可氧化脂质、蛋白质和 DNA
光产物生成路径:产生具有光敏活性或细胞毒性的新光产物,引发级联损伤
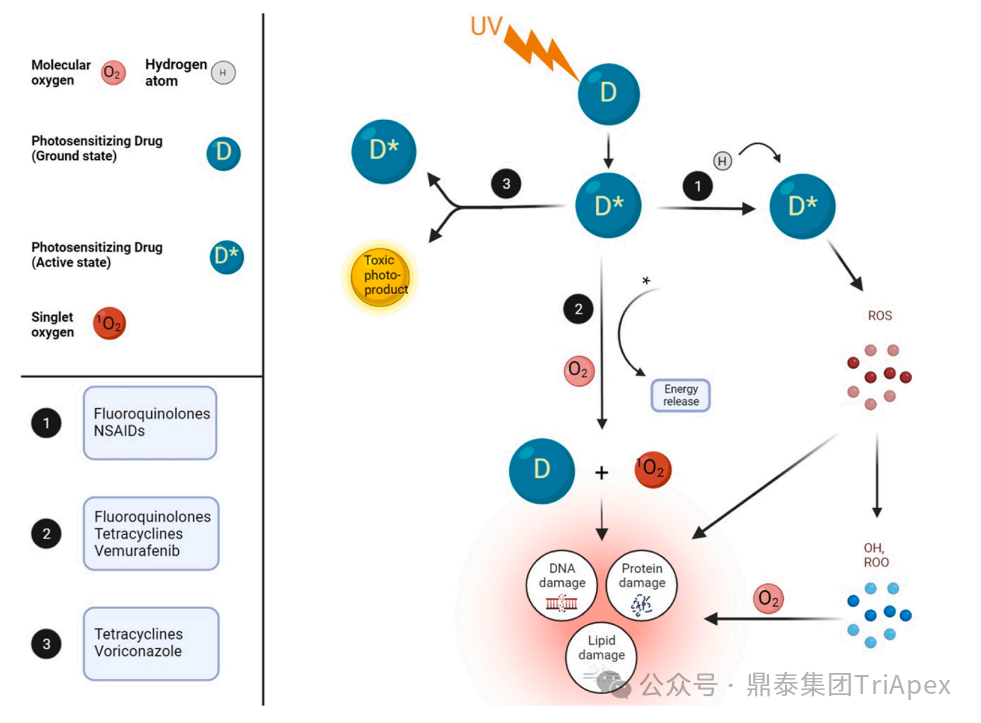
图1. 光毒性作用机制
胺碘酮(Amiodarone)、氯丙嗪(Chlorpromazine)、多西环素(Doxycycline)、氢氯噻嗪(Hydrochlorothiazide)、洛美沙星(Lomefloxacin)、萘普生(Naproxen)、威罗菲尼(Vemurafenib)和伏立康唑(Voriconazole)等为现有已知的在临床具有光毒性反应的药物。这些药物的化学结构式中均含有化学不饱和结构(如双键、芳香基团或两者兼有),使其能够吸收紫外线(UV),产生单线态(¹O₂)和三线态(³Sens)的电子激发态,最终引发皮肤光毒性反应。已知具有光毒性反应的药物汇总见表1。
表1. 已知光毒性药物汇总
触发光安全性评价的条件
如果需要,通常在大样本受试者应用的临床试验(Ⅲ期)开展前进行光安全性评价,光安全性评价时,首先需考察药物在 290 nm-700 nm 波长范围内是否吸收光子,然后计算摩尔消光系数(MEC)。若 MEC 低于 1000 L/mol/cm,可直接判断该药物不具有光毒性,否则,可以通过非临床组织分布试验结果考察药物在光暴露组织(如皮肤、眼)是否有分布,如有分布且药物在体内组织消除半衰期较长,需进行光安全性试验。
除此之外,若药物具有与光毒性药物类似的化学结构式,或临床或非临床上提示该药物有光毒性风险,也需进行光安全性试验。光安全性评价决策树见图2。
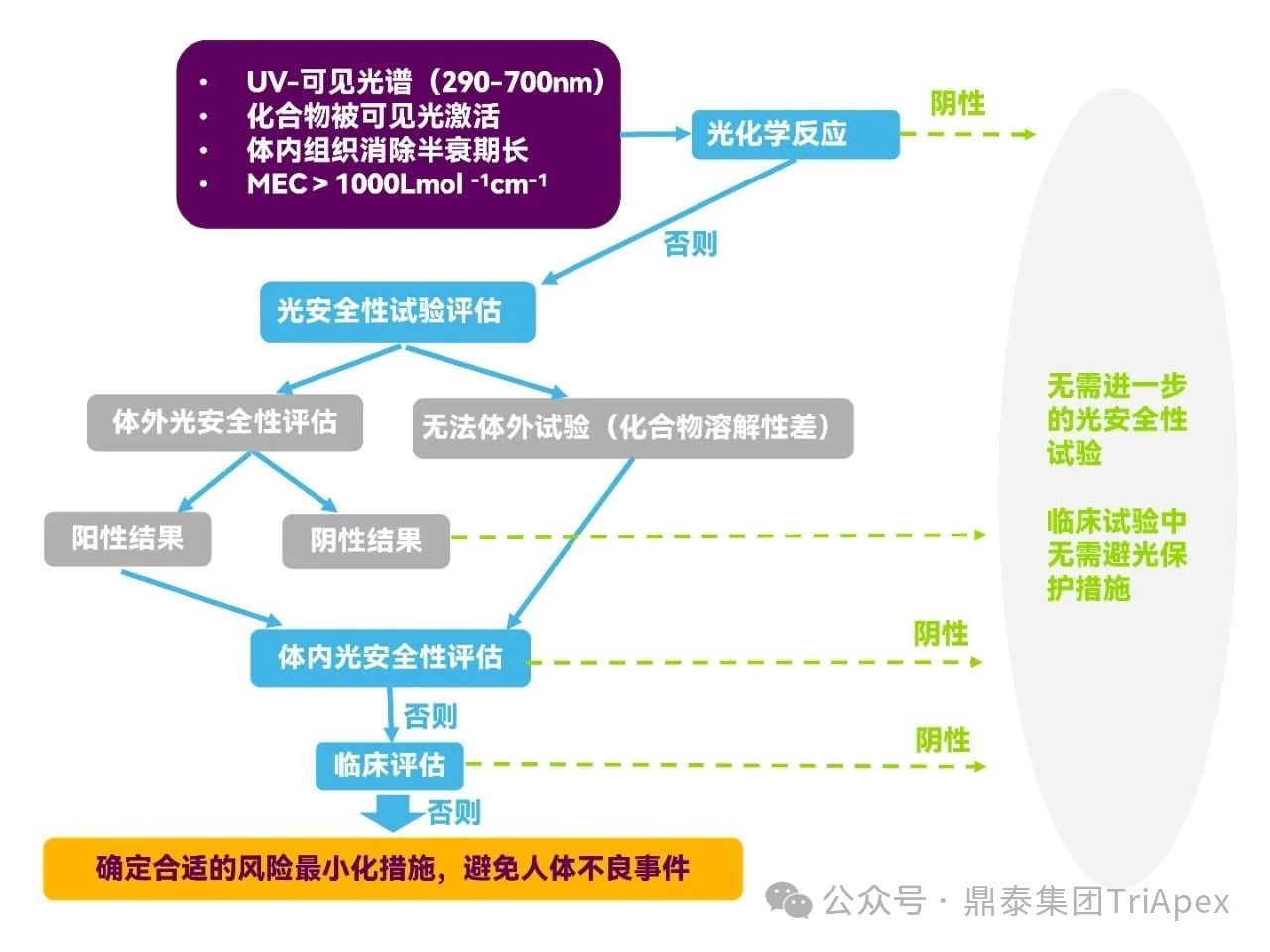
图2. 光安全性评价决策树
体外光安全性评价
现行经过验证的体外光安全性试验方法有 3T3 中性红摄取光毒性试验法(3T3 NUR-PT)、红细胞光毒性试验法(RBC-PT)以及重组人体皮肤模型光毒性试验法(H3D-PT),其中 3T3 NUR-PT 是唯一通过 ECVAM 验证并被 OECD 接受的体外光安全性试验方法,于 2004 年正式作为 OECD TG 432 发布,该方法也是目前被 EMA、FDA 和日本厚生劳动省等监管机构认可的唯一体外光安全性测试方法。
3T3 NUR-PT 通过比较受试物在紫外线/可见光(UV/VIS)照射与未照射条件下对细胞存活率的影响,评估细胞光毒性。该试验具有灵敏度高但预测特异性较低的特点(灵敏度 93%,特异性 84%),其中高灵敏度使其阴性结果具有较好的预测性,但阳性结果不能作为临床具有光毒性风险的标志,仅提示需要进一步评估(体内光安全性试验)。
☆ 且该试验有以下局限性
无法预测受试物与光共同作用引发的光遗传毒性
无法预测光过敏(光敏反应)或光致癌性等其他不良反应
仅用于危害识别,不适用于评估光毒性毒力
尤其需要注意的是,该试验体系缺乏代谢活性,而代谢激活对系统性暴露化学物质的毒性表现至关重要。因此,对于此类需要代谢活化的系统性暴露化学物质,推荐进行体内光安全性试验。
体内光安全性评价
1
实验动物的选择
在进行体内光安全性试验选择动物种属时应考虑动物光照敏感性、耐热性等因素。目前包括豚鼠、小鼠和大鼠在内的许多动物种属,被用于进行体内光安全性试验。
有研究表明,SD 大鼠和豚鼠在评估光毒性潜力上是一致的,但由于 SD 大鼠在一般毒理研究中被广泛应用,可无需额外收集数据(如 PK 数据),缩短研究周期,通常推荐使用 SD 大鼠。
有或无色素沉着皮肤的动物均可用于评估光安全性,其中无色素沉着皮肤的动物用于评估光安全性更敏感,但对于与黑色素结合(如体外合成黑色素结合实验获得)的药物应优先考虑有色素沉着皮肤的动物(如Brown Norway 大鼠、Long-Evans 大鼠)。
2
辐射条件的选择
UVA 与 UVB 紫外线的作用机制及差异(见图3):
长波紫外线(UVA,320–400 nm)的生物学活性虽弱于中波紫外线(UVB),但其较长的波长使其能够穿透至真皮层,从而与沉积在深层组织(如真皮血管、毛囊)的药物发生光毒性反应
中波紫外线(UVB,290–320 nm)波长较短,以引发晒伤(红斑、水肿)为主要特征,主要作用于表皮层,具有更强的直接损伤细胞的能力,并在皮肤癌变(如鳞状细胞癌、基底细胞癌)的发生中起主导作用
几项研究表明,光毒性反应最常发生于 UVA 照射,而可见光和 UVB 照射则不太常见,当前的体外和体内光安全性试验,已成功应用的剂量范围为 5-20 J/cm2 的 UVA(有研究表明,在SD大鼠上,10 J/cm2 的 UVA 是最佳照射剂量),该照射剂量与夏季正午时分、在温带地区海边长时间户外活动时的光照剂量相当。对于全身用药来说,UVA 光化学活化的临床相关性较 UVB 更重要,而 UVB 照射与应用于光暴露组织的局部用药相关,在选择剂量时可考虑先进行最小红斑剂量(MED)试验,选择未观察到红斑的照射剂量。其次照射时间点需结合药代动力学信息,选择在 Tmax 附近的时间点进行照射。
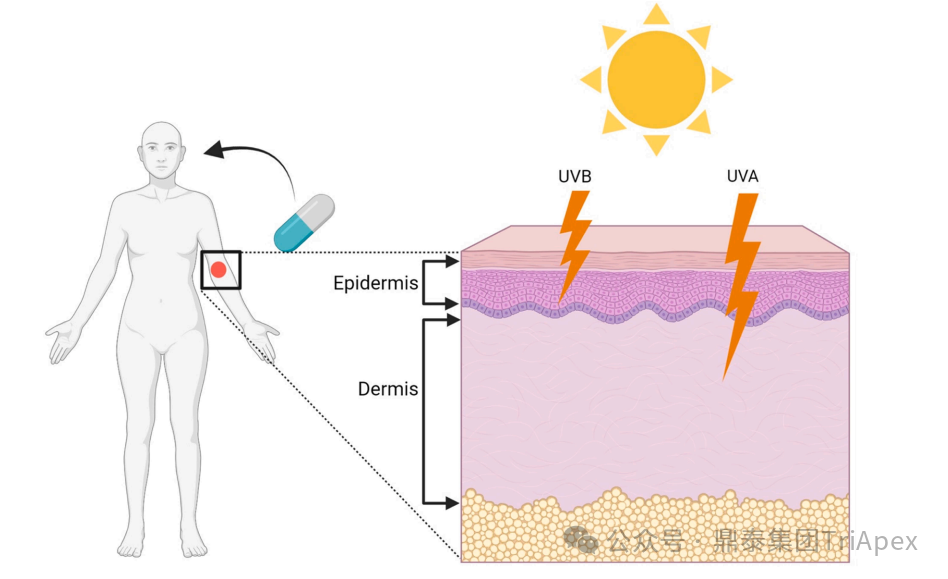
图3. UVA 与 UVB 紫外线作用机制
3
试验周期和剂量的设计
参考临床给药途径及给药频率,合理选择可行的单次或几天的给药期限。高剂量的选择应符合 ICH M3(R2)中的推荐,如果在高剂量下呈阴性,则无需设置低剂量。反之,则需设置低剂量组以便获得 NOAEL;另需设置不进行照射的对照组、空白对照以及阳性对照组,以帮助识别药物相关的光毒性且能区分非照射引起的不良反应。如果试验方法已经验证确认则可不设置阳性对照组。需注意如果在动物体内抵达的最大系统暴露量低于人临床暴露,则阴性结果不足以预测临床的风险。
4
检测指标
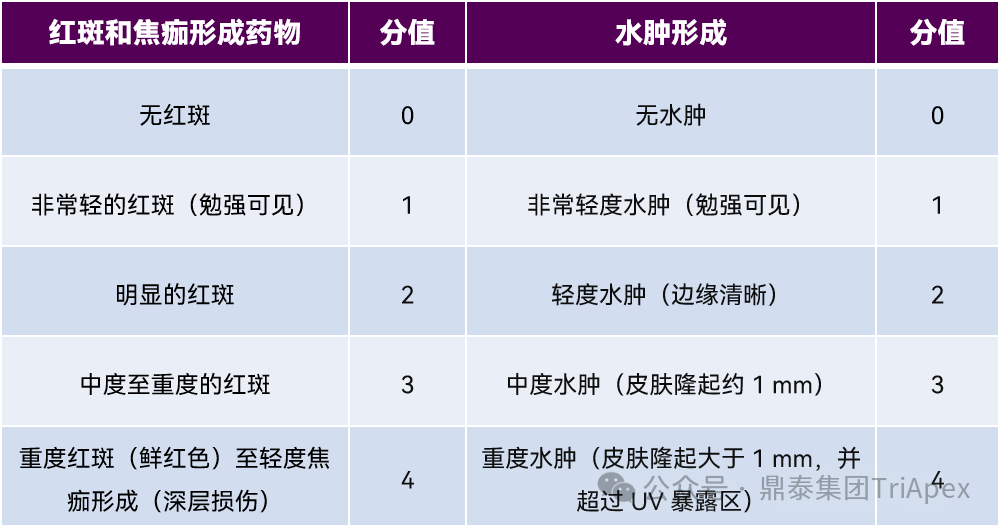
照射后观察照射区域皮肤反应,包括红斑和水肿等(表2,通常涂受试物后经照射的区域出现皮肤反应分值之和≥2 的动物数≥1 只时,判为受试物具有光毒性),可进一步对照射区域进行组织病理学检查;可设置额外的检测指标(如,提示急性光刺激性的皮肤或淋巴结中早期炎症标记物),进一步为风险鉴定提供支持性信息;吸收光线超过 400nm 的全身暴露药物,需采用详细的组织病理学检查评估视网膜光毒性。
表2. 光安全性评价标准
体内外光安全性评价案例分析
案例1 Ceritinib(Zykadia®)
Ceritinib(色瑞替尼,商品名 Zykadia®)是酪氨酸激酶抑制剂(TKI)药物,用于间变性淋巴瘤激酶(ALK)阳性晚期非小细胞肺癌(NSCLC)患者的治疗。Ceritinib 的结构式如下图4,可看出 Ceritinib 含有生色团(分子中能吸收特定波长光能并产生电子跃迁的原子基团),如嘧啶环、苯环;含有助色团(指本身不吸收紫外-可见光,但能增强生色团吸收能力或改变吸收波长的基团),如氯原子(CL)、氨基(-NH-)、烷氧基(-OCH(CH3)2)、磺酰基(-S(=O)2-)。并在药理毒理学研究中得知,Ceritinib 在猴和大鼠中呈现较长的半衰期,在大鼠皮肤、眼睛中均有分布。基于此,Ceritinib 首先开展了体外光安全性研究。
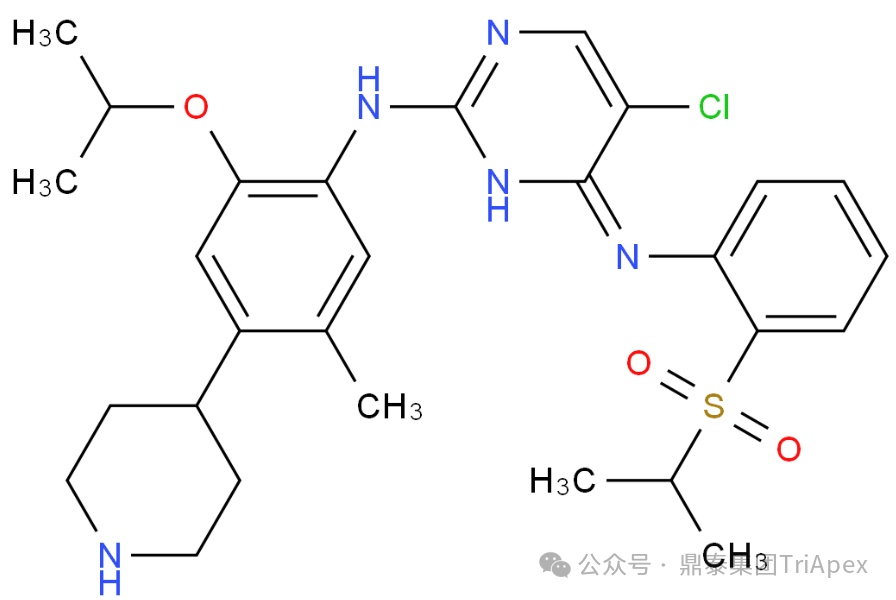
图4. Ceritinib(色瑞替尼)的结构
★ Ceritinib 体外光安全性试验(体外 3T3 中性红摄取试验)
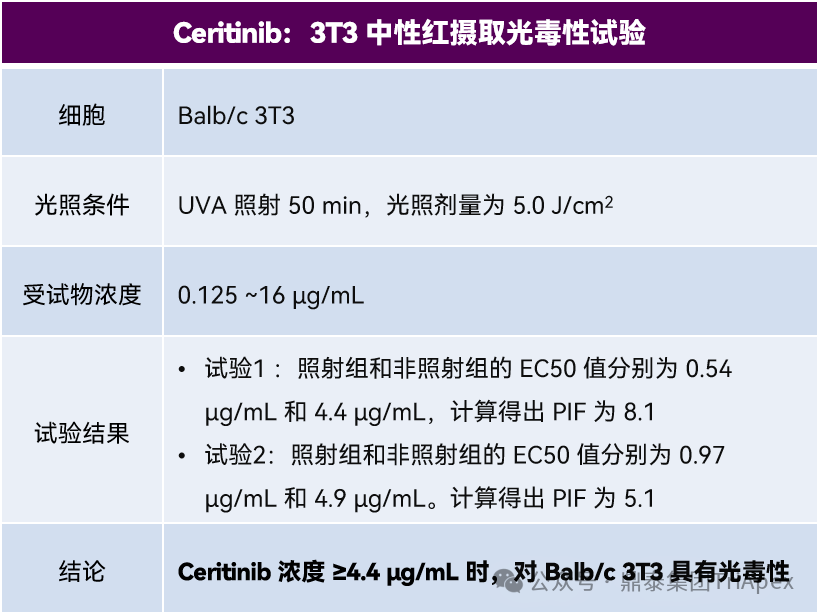
Balb/c 3T3 成纤维细胞用浓度范围为 0.125 至 16 µg/mL 的 Ceritinib 处理 1 小时,然后进行照射。其中一组培养板暴露于 5.0 J/cm² 的 UVA 下 50 分钟,同时对照组培养板在相同时间段内置于黑暗条件下。在照射和孵育大约 20 至 22 小时后,通过中性红摄取试验(Neutral Red Uptake assay)评估细胞毒性。计算光刺激值(Photo-Irritation Factor, PIF),PIF>5.0 表明具有光毒性潜力。氯丙嗪(Chlorpromazine)作为阳性对照。下表3为 Ceritinib 体外光安全性试验设计和相关结果,如下表所示,Ceritinib 体外光安全性试验结果为阳性。
表3. Ceritinib 体外光安全性试验设计和结果
★ Ceritinib 体内光安全性试验
基于体外光安全性试验阳性结果,故进一步进行体内光安全性研究(改良版局部淋巴结试验,LLNA),该试验旨在通过口服暴露和 UVA 照射来识别 Ceritinib 的光毒性潜力。受试物 Ceritinib 以 10、30 或 100 mg/kg/d 的剂量给予小鼠,连续给药 3 天,每组 6 只动物,给药后,使用 10 J/cm2 的 UVA 照射 165-195 分钟,在第 4 天处死动物后,收集耳朵、耳部淋巴结(制备淋巴结悬液用于比较细胞计数)和腹部皮肤样本。下表4是 Ceritinib 体内光安全性试验设计和结果,结果显示,Ceritinib 在小鼠体内不具有光毒性风险。
表4. Ceritinib 体内光安全性试验设计和结果

案例2 DS-8201(Enhertu®)
DS-8201(德曲妥珠单抗,商品名 Enhertu®)是一款靶向 HER2 的抗体偶联药物(ADC),临床上用于乳腺癌、胃癌以及非小细胞肺癌等的治疗,其毒素小分子为新型拓扑异构酶I抑制剂 DXd(Deruxtecan),DXd 为喜树碱衍生物,其母核含共轭结构,可能具备紫外吸收潜力。DS-8201 的毒素小分子 DXd 首先在体外采用 Balb/c 3T3 小鼠成纤维细胞评估光毒性潜力(试验设计和结果见下表5),试验结果显示,DXd 在体外光安全性试验结果为阳性。
表5. DXd 体外光安全性试验设计和结果

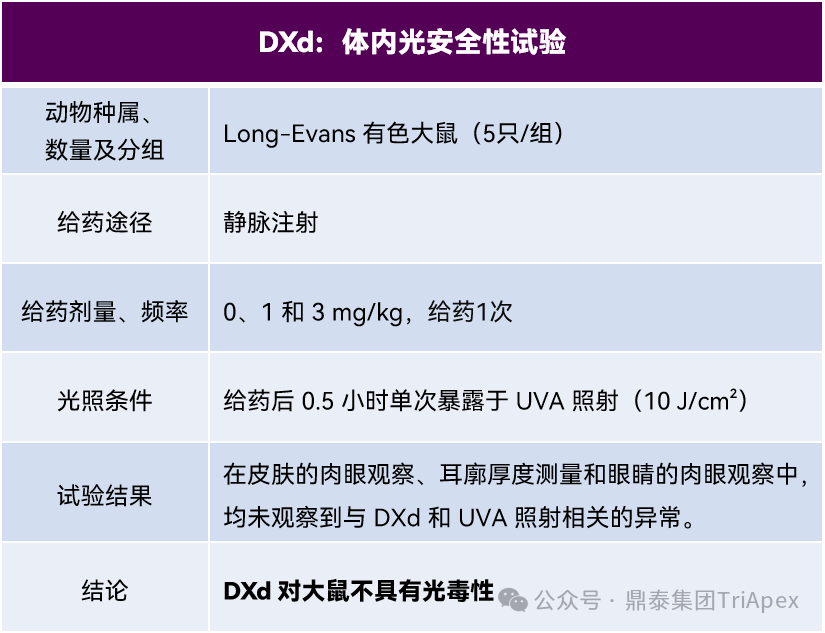
基于上述体外光安全性试验阳性结果,故在大鼠中进行体内光安全性试验(见下表6)。在有色大鼠体内单次给药光毒性研究中,即使以最高试验剂量(3 mg/kg)给药,也未观察到光毒性反应。该剂量下大鼠血浆中 DXd 浓度达 90.5 ng/mL,相当于临床研究中患者接受 DS-8201推荐剂量 5.4 mg/kg 后观测到的 Cmax(7.2 ng/mL)的 13 倍。基于体内研究结果,认为 DS-8201 不具有光毒性风险。
表6. DXd 体内光安全性试验设计和结果
结语
研究人员在对药物进行光安全性评估时,首先应考察其紫外可见吸收光谱并计算 MEC,对于 MEC 不低于 1000 L/mol/cm 的药物,可进行光反应试验(ROS试验),若为阴性,无需进一步进行光安性试验;其次评估药物体内分布情况,在确定需进一步进行光安全性试验时,推荐优先考虑体外替代试验,若为阳性,则进一步进行体内光安全性试验。目前,分阶段的光安全性评估方法已被全球监管广泛认可。现行的光安全性评价方法有很多,但每种试验方法都有其局限性,如目前暂无可以评估眼毒性的合适的体外模型,体内光安全性试验没有标准的检测指标,体内和体外光安全性试验结果与临床数据的关联性有待进一步研究等。
供稿:毒理Ⅰ部
参考资料: