
2025-08-20 09:59:42来源:鼎泰集团TriApex浏览量:786
2024年12月19日,Ionis Pharmaceuticals 开发的 Olezarsen(Tryngolza™)获 FDA 批准上市,成为 FDA 首个治疗家族性乳糜微粒血症综合征(FCS)的药物,开启了精准降脂治疗的新篇章。鼎泰团队始终关注并专注于助力代谢类寡核苷酸药物(包括 siRNA、ASO、AOC 等)的研发,通过本期内容进一步挖掘有价值的临床转化新思路,持续为客户提供卓越服务。
全文共:8955 字 56 图
预计阅读时长:30 分钟
★ 文章导览 ★
01 | 前言 |
02 | FCS,亟待攻克的代谢性罕见病 |
03 | 反义寡核苷酸 Olezarsen,靶向 ApoC3 的降脂新选择 |
04 | Olezarsen 临床开发路径 4.1 Ⅰ/Ⅱa 期试验 [NCT02900027] 4.2 Ⅲ 期试验(ISIS 678354-CS3)-核心证据 [NCT04568434] 4.3 Ⅱb 期试验(ISIS 678354-CS8)-支持性证据 [NCT05355402] |
05 | Olezarsen 非临床研究内容及与临床的相关性 药理学/药代动力学/毒理学/免疫原性 |
06 | FDA 审批决策依据 |
07 | 监管互动 |
08 | 同类产品研究进展 |
09 | 结语 |
前言
动脉粥样硬化性心血管疾病(ASCVD)是全球范围内造成人类健康威胁的主要慢性非传染性疾病之一,其发生和发展与血脂代谢异常密切相关。虽然他汀类药物作为血脂管理的基石在临床中被广泛使用,但仍有相当一部分患者难以通过现有治疗方案实现理想的降脂目标。
近年来,PCSK9 抑制剂因其显著的 LDL-C 降低效果备受关注,其中基于长效 siRNA 技术的 Inclisiran 展现出了持久的降脂作用。在血脂管理中,低密度脂蛋白胆固醇(LDL-C)达标后,非高密度脂蛋白胆固醇(non-HDL-C)通常作为次要干预目标进入临床关注视野。对于那些即使 LDL-C 和 non-HDL-C 均已达标,但甘油三酯(TG)仍异常升高的 ASCVD 高危及以上患者,联合降 TG 治疗可进一步降低心血管事件风险。然而,传统降 TG 药物联用方案虽然能在一定程度上改善血脂水平,但其对 TG 的降幅有限,难以满足临床对更深层次降脂的需求。
靶向载脂蛋白 C3(ApoC3)的新型药物为这一治疗难点提供了新的解决思路,这类药物可通过增加脂蛋白脂肪酶(LPL)活性来减少 TG 水平,也可通过增加低密度脂蛋白受体(LDLR)和低密度脂蛋白受体相关蛋白 1(LRP1)对脂蛋白及其残粒的清除能力进一步调控 TG 和胆固醇水平。靶向 ApoC3 药物主要包括 ASO、siRNA 和单抗。
首款靶向 ApoC3 的 ASO 药物 Volanesorsen 已在欧盟获批用于治疗家族性乳糜微粒血症综合征(FCS),并在巴西获批用于家族性部分脂肪营养不良和 FCS,但由于存在血小板减少风险,未能在美国获批。后来,采用 GalNAc3 偶联技术的 Olezarsen 通过增强肝脏靶向性,使得给药剂量更低、注射体积更小、频率更低,从而可能降低血小板减少等不良事件的风险。目前,该药物已在美国获批用于治疗 FCS,且正在全球范围内开展针对严重高甘油三酯血症(HTG)的III期临床研究。
Olezarsen 的快速上市,不仅认证了 ApoC3 靶点的科学价值,更展现了 RNAi 疗法在代谢性疾病中的巨大潜力。本期内容我们将复盘其非临床及临床开发路径,解析其成功背后的关键策略,也借助该产品进一步了解在 siRNA 研发热潮下仍然炙手可热的 ASO 药物的开发潜力。
FCS,亟待攻克的代谢性罕见病
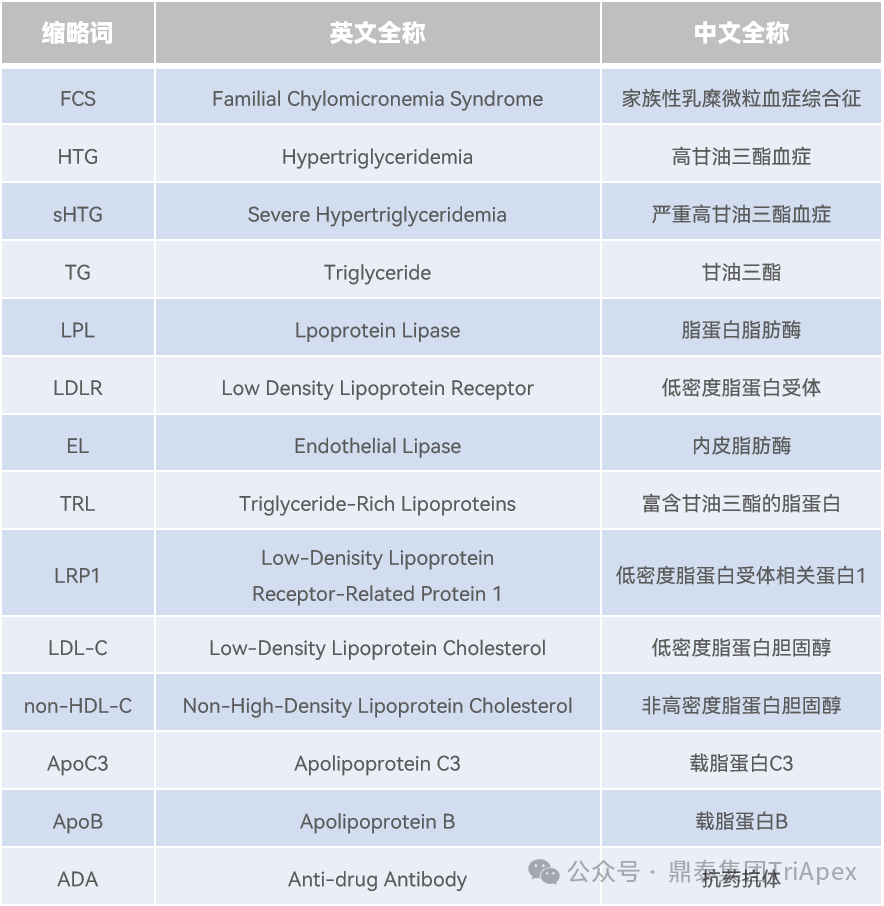
FCS 是一种罕见的常染色体隐性遗传病,发病率约为 1-10 例/百万。该病由 LPL 或与 LPL 活性相关的基因中的双等位基因功能丧失变异引起。LPL 活性的丧失导致其在富含 TG 的脂蛋白中水解 TG 的能力下降,如肠道来源的乳糜微粒和肝脏来源的极低密度脂蛋白,这些物质在血浆中积累,导致严重的 HTG。
FCS 的主要并发症是急性胰腺炎和复发性发作,这些症状最早可在婴儿期,即出生后 30 天内出现。大约 85% 的患者报告至少有一次急性胰腺炎发作,40% 的患者多次复发。HTG 诱发的急性胰腺炎是一种高致死率危重症,可引发多器官功能衰竭,需要住院治疗,院内死亡率最高达 8%。
核心临床表现
最严重的并发症:可能危及生命的急性胰腺炎
典型症状:阵发性腹痛、疲劳、抑郁等
特征性体征:爆发性皮肤黄色瘤、视网膜脂血症、肝脾肿大
发病特点:症状通常在儿童期或青春期开始显现
治疗现状与挑战
目前主要治疗手段为严格限制脂肪摄入的低脂饮食,虽有一定效果但患者依从性较差
现有的降脂药物(如贝特类和鱼油制剂)对 FCS 患者基本无效。目前美国 FDA 尚未批准任何针对 FCS 的特效药物,存在高度未满足的临床需求

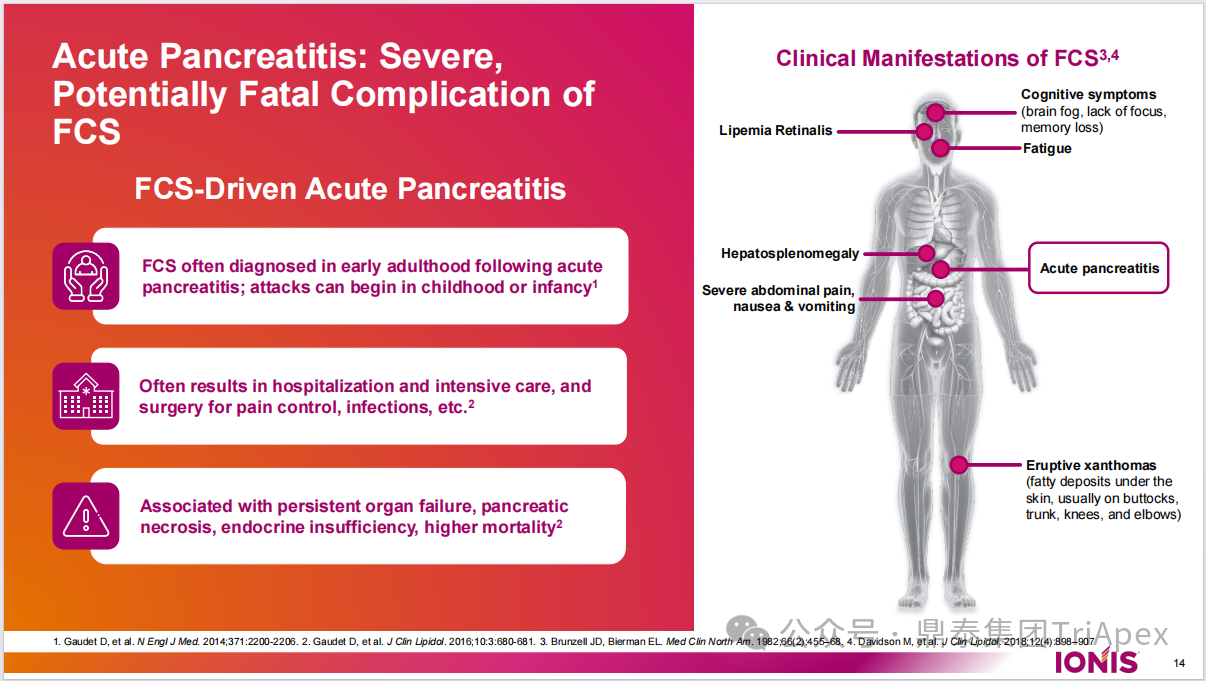
图1. FCS 主要临床表现
FCS、sHTG 和 HTG 患者的临床特征不同
FCS(TG>880 mg/dL)
单基因
LPL 活性丧失
显著减少的 TRL 清除
对降 TG 疗法的抵抗
sHTG(TG>500 mg/dL)
多基因
功能正常但潜在的 LPL 活性降低
功能正常但 TRL 清除减少
HTG(TG>150-500 mg/dL)
心血管或代谢风险因素,包括肥胖、糖尿病、代谢综合征、高 LDL-C 等

图2. FCS、sHTG 和 HTG 患者临床特征
反义寡核苷酸 Olezarsen,
靶向 ApoC3 的降脂新选择
ApoC3 作为 TG 代谢的关键调节因子,通过 LPL 依赖性和非依赖性途径发挥作用。Olezarsen 通过反义作用机制抑制 ApoC3 的产生,可减轻 ApoC3 对 TG 清除的抑制作用,进而有效降低 TG 水平。在临床上,TG 这一血脂标志物已被广泛用作评估胰腺炎风险降低的替代指标,也是 HTG 患者使用降 TG 药物获得完全批准的基础。
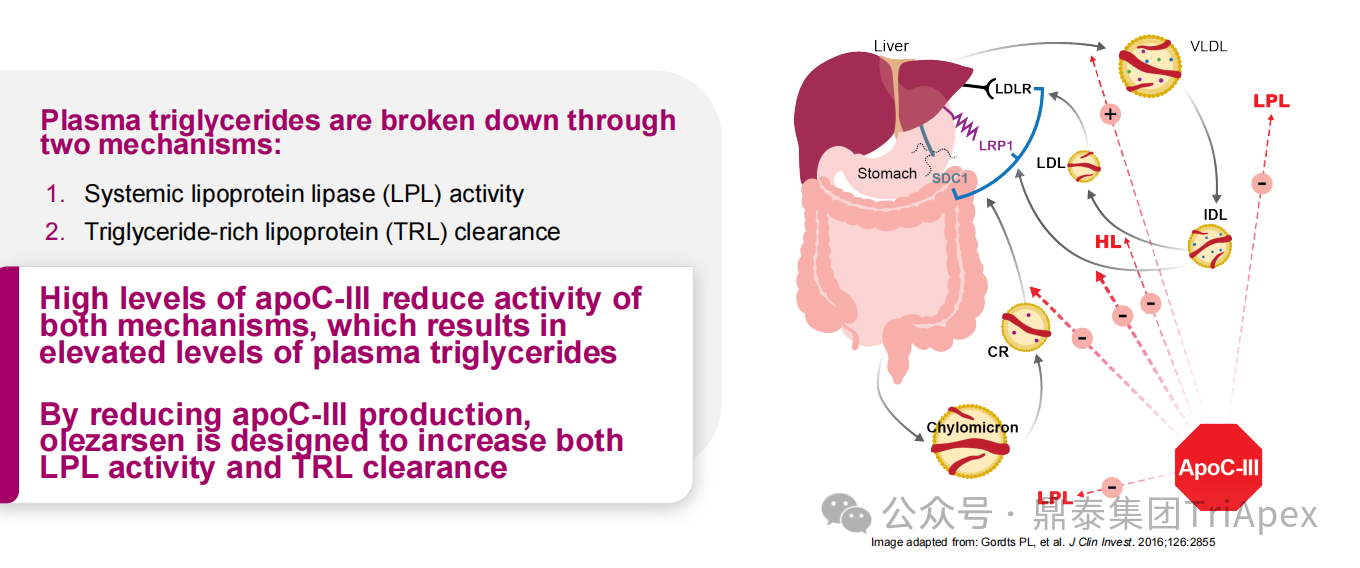
图3. ApoC3 是 TG 代谢的关键调节因子
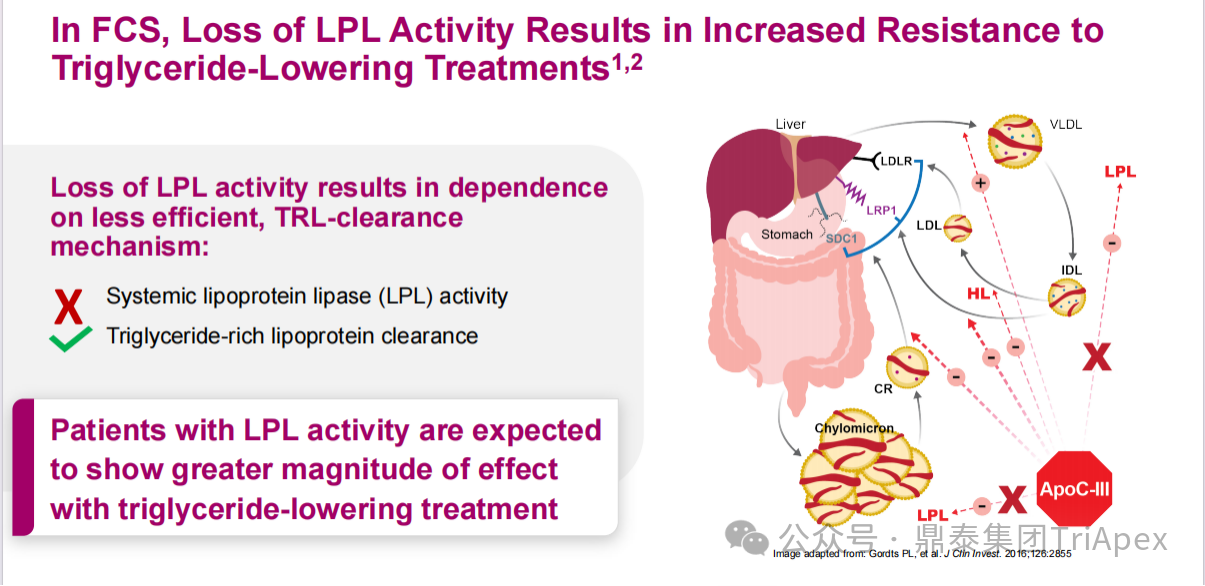
图4. FCS 患者 LPL 活性降低
Olezarsen 是一种靶向 ApoC3 的 ASO,拟用于作为饮食辅助疗法降低成人 FCS 患者的 TG 水平。其通过连接子共价结合 GalNAc3,实现 ASO 向肝细胞的靶向递送。能通过结合 ApoC3 mRNA 促使 mRNA 降解,从而降低血清 ApoC3 蛋白水平。
Olezarsen 与其前体药物 Volanesorsen 具有相同的核苷酸序列。Volanesorsen 于 2019 年获得 EMA 附条件上市许可,用于治疗高胰腺炎风险的 FCS 患者,此前在 2018 年因血小板减少风险被 FDA 发出完全回复函(CRL)。Olezarsen 通过 GalNAc 偶联技术与 Volanesorsen 形成差异化优势,使其可采用不同的给药方案(每 4 周皮下注射 80 mg [Q4W]),而 Volanesorsen 需每周皮下注射 300 mg [Q1W]。
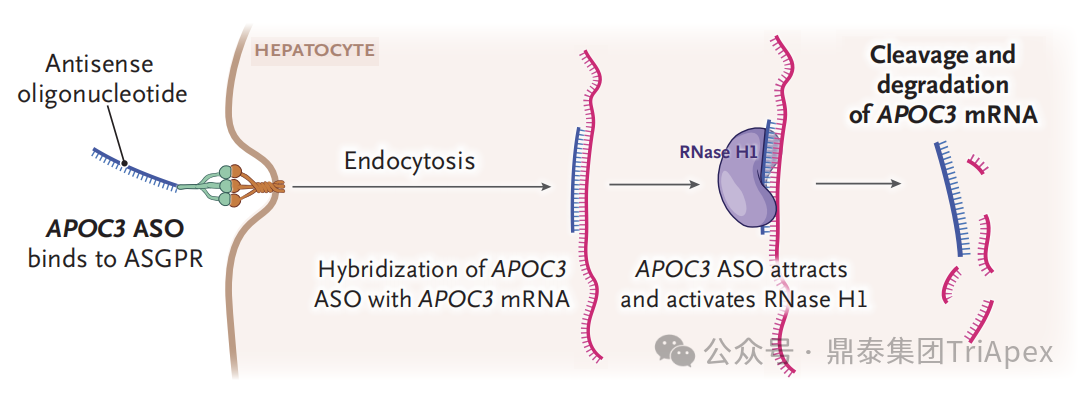
图5. Olezarsen 作用机理示意图
2024年12月19日,Olezarsen 获得 FDA 批准,商品名为 Tryngolza™,为全球 FCS 患者带来新希望,同时也将为 RNAi 在重大疾病领域的应用奠定基础。
Olezarsen 临床开发路径
截至目前,Olezarsen 已开展了多项临床试验,其中支持 Olezarsen 上市的核心证据为 Ⅲ 期临床试验 ISIS 678354-CS3(NCT04568434);此外 Ⅱb 期临床试验 ISIS 678354-CS8(NCT05355402)为支持性证据。
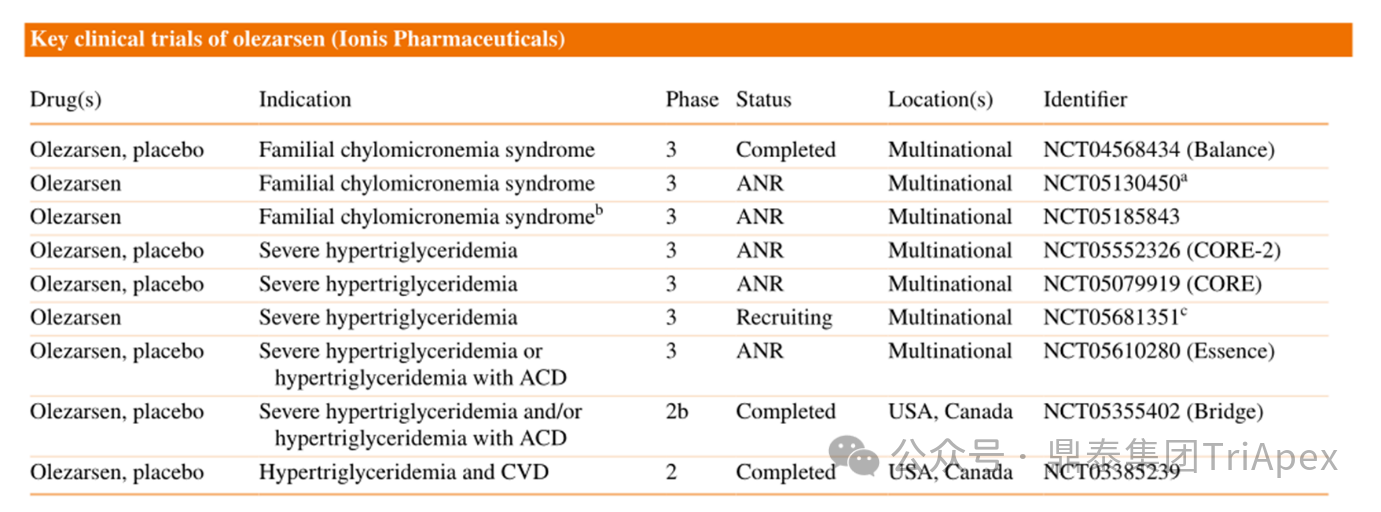
图6. 关键临床试验
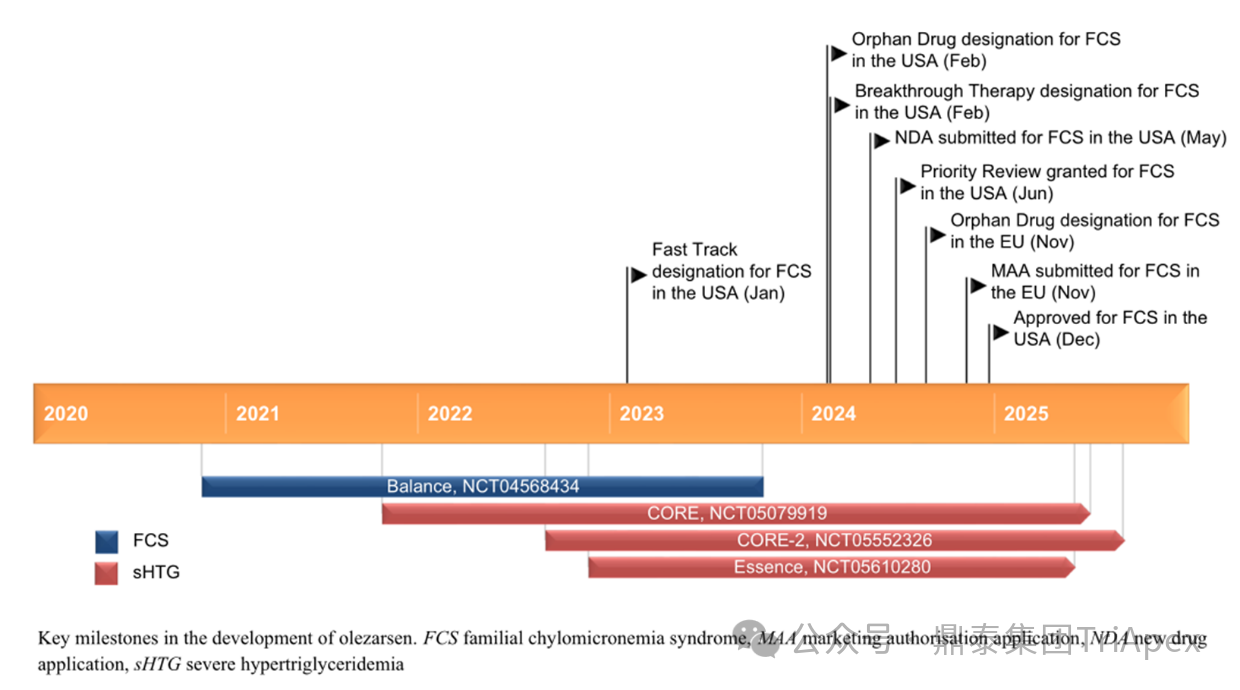
图7. 临床开发路径
1
Ⅰ/Ⅱa 期试验 [NCT02900027]
这项 Ⅰ/Ⅱa 期、双盲、随机、安慰剂对照、剂量递增研究评估了 Olezarsen(AKCEA-APOCIII-LRx)皮下给药后在健康受试者中的安全性、耐受性、药代动力学和药效学。该试验于2016年8月至2018年4月期间,在加拿大进行。

图8. Ⅰ/Ⅱa 期临床试验设计
研究设计
单剂量递增试验设置五个队列(N=8,受试物:安慰剂为 6:2),分别采用 10、30、60、90 和 120 mg 剂量。10、30 及 60 mg 剂量组要求受试者空腹 TG 水平 ≥90 mg/dL,90 和 120 mg 组则要求 ≥200 mg/dL。
多剂量递增试验中,所有受试者的空腹 TG 水平均需 ≥200 mg/dL。探索 2 种不同的给药方案:
每周给药队列(N=8,受试物:安慰剂为 6:2)采用 15 和 30mg 剂量
每四周给药队列(N=10,受试物:安慰剂为 6:4)采用 60 mg剂量。
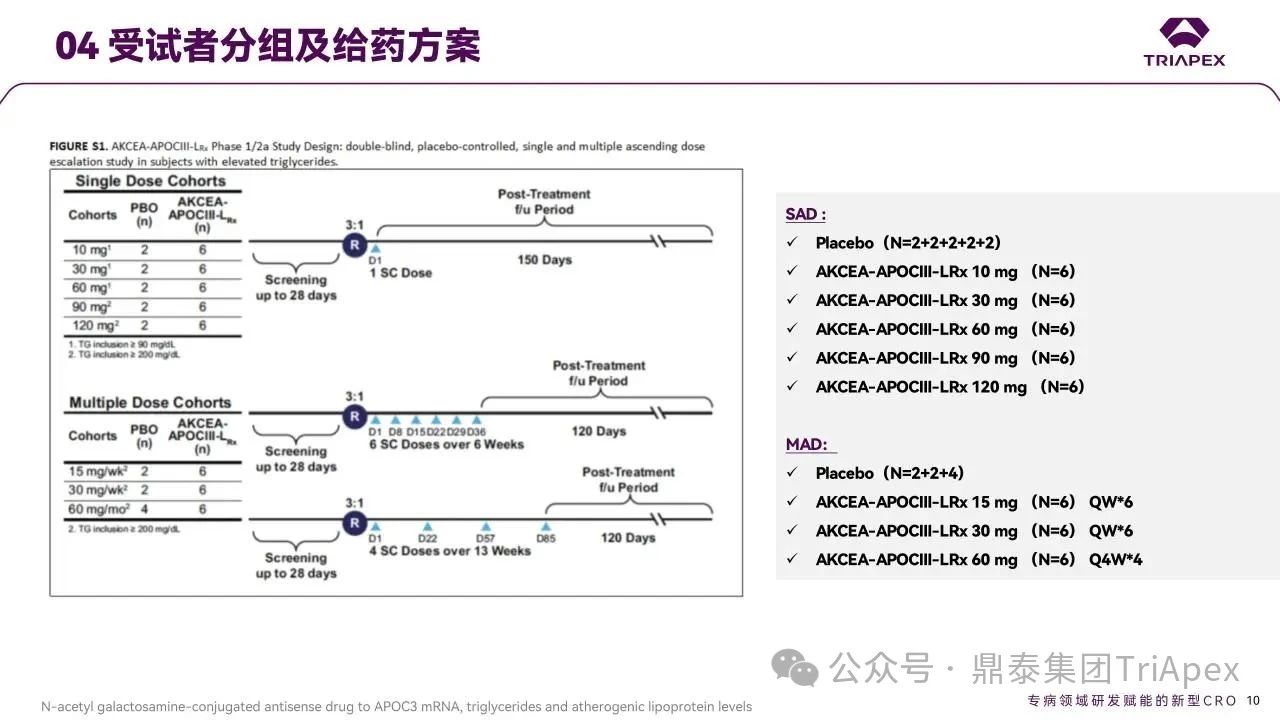
图9. Ⅰ/Ⅱa 期试验分组及给药方案
剂量设计依据
关于 Olezarsen 临床起始剂量的设计依据,暂未见相关资料中有披露。
根据当时已获得的在 TG 水平极高的转基因小鼠研究(study No. EX/3979-73、23-144a)的数据,0.3 mg/kg 剂量下未见明显的肝脏 ApoC3 mRNA 、血浆 ApoC3 蛋白和 TG 水平降低,1 mg/kg 为观测到的药效起效剂量。
基于此,笔者对临床剂量推算提出两种假设:
(1)按体重法直接进行种属间剂量外推(1:1)
0.3 mg/kg*60 kg =18 mg,基于此推测 10 mg 为预计不会产生药理学活性的剂量;
(2) 经种属换算系数调整(÷5)
根据相关文献报道,对于 2'-MOE 修饰的 ASO,直接使用 BSA 或 BW 法进行的种属间剂量换算均无法准确预测小鼠与人类间的稳态 AUC 比值;通过引入校正因子(BW 比值除以 5 或 BSA 比值 以2)可显著改善预测准确性:
1 mg/kg*60 kg÷5=12 mg,基于此推测 10 mg 为预计产生药理学活性剂量。

上述推算仅为基于有限的动物数据的理论推演,在实际的首次人体试验起始剂量选择时不排除综合考虑了其他因素。笔者也深刻地意识到,目前 RNA 靶向药物研发中,从临床前到临床的剂量转化暂无普适性标准,需要结合具体药物的特性、平台研究基础进行综合评估。
研究结果
单剂量队列中,受试者分别接受 10、30、60、90 或 120 mg AKCEA-APOCIII-LRx 治疗后第14天,ApoC3 中位降幅分别为0、-42%、-73%、-81% 和 -92%,TG 中位降幅分别为-12%、-7%、-42%、-73% 和 -77%。
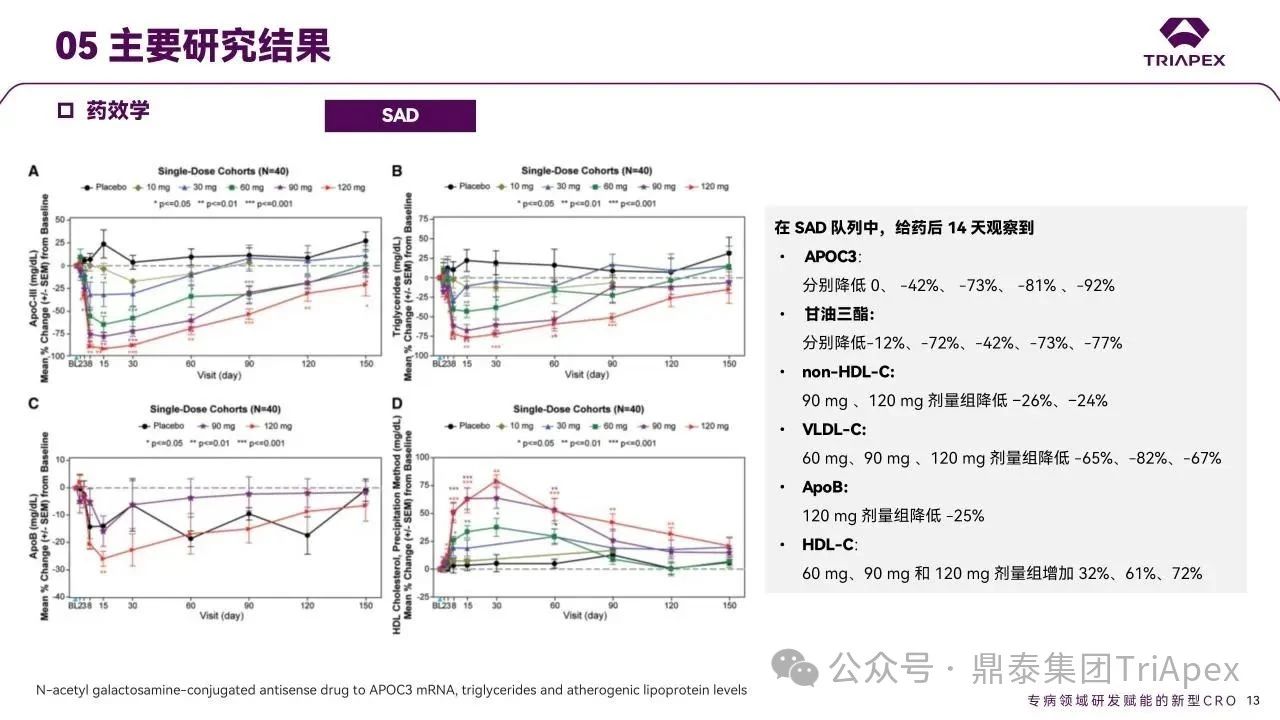
图10. SAD 队列受试者药效学结果
多剂量队列(QW 15/30 mg 及 Q4W 60 mg)末次给药 1 周后,ApoC3 中位降幅达-66%、-84% 和 -89%,TG 降幅分别为 -59%、-73% 和 -66%。同时观察到总胆固醇、ApoB、non-HDL-C、VLDL-C 显著降低, HDL-C 水平升高。
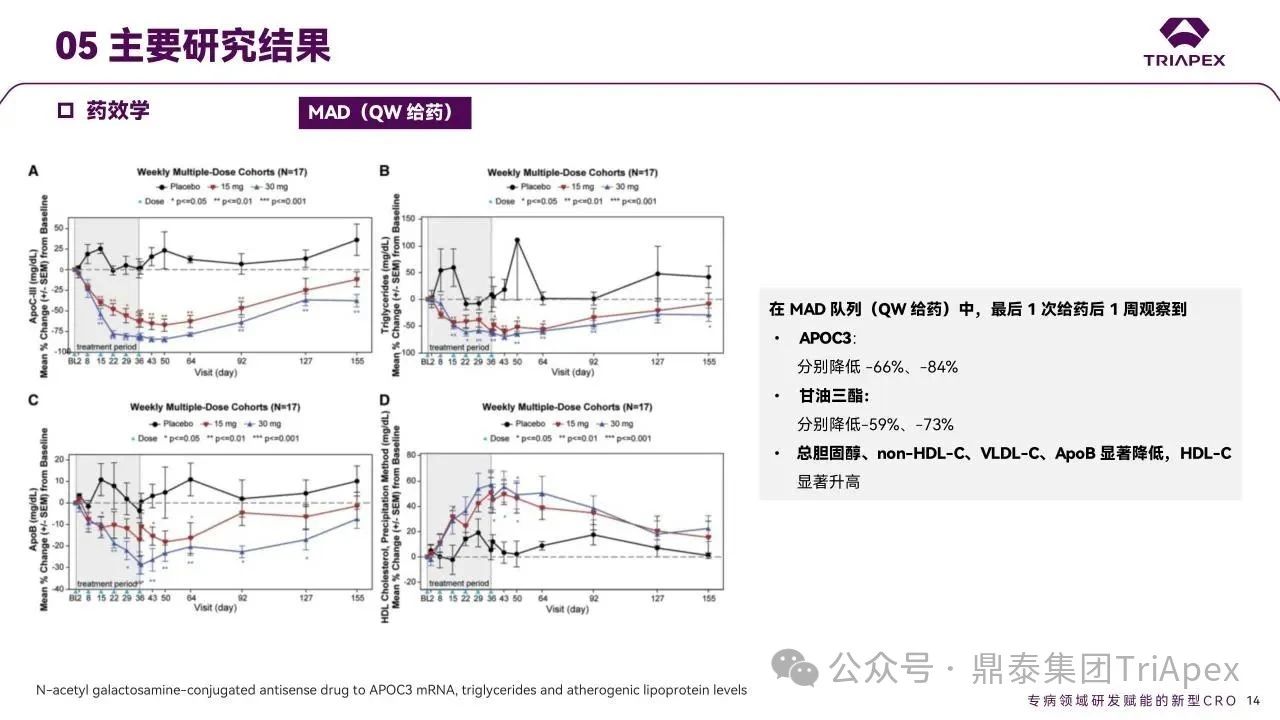
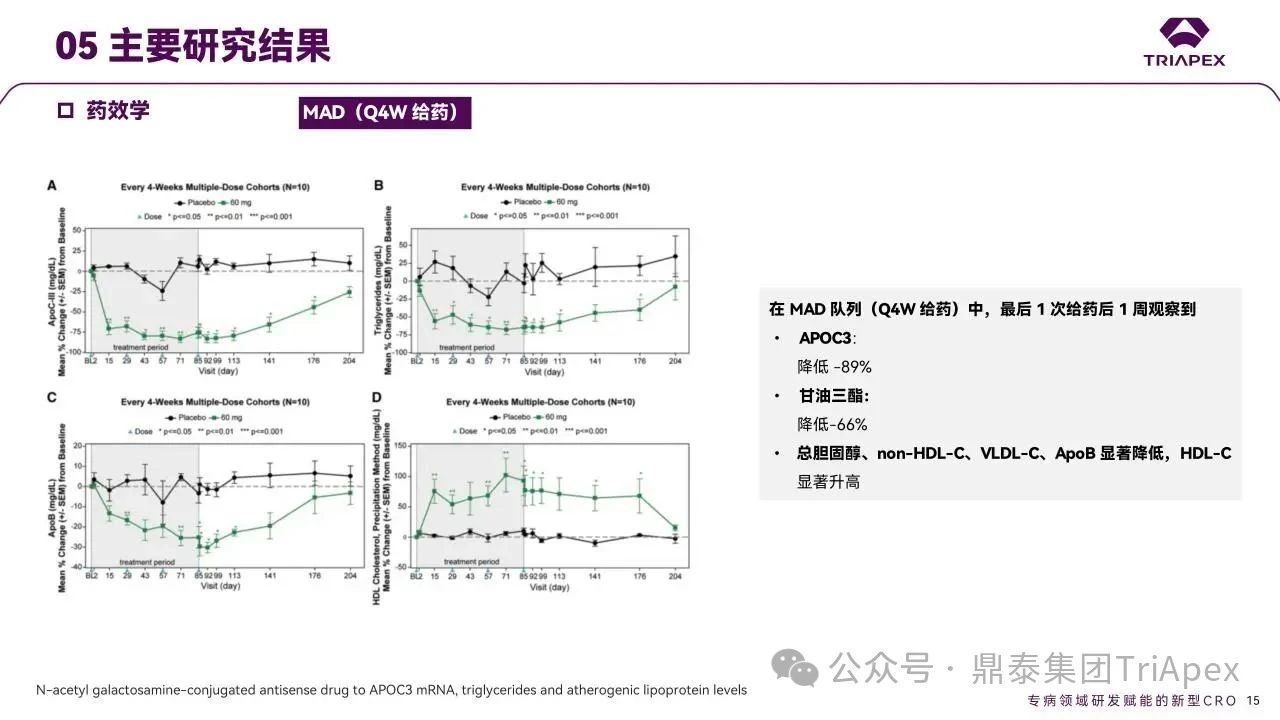
图11. MAD 队列受试者药效学结果
AKCEA-APOCIII-LRx 耐受性良好,仅报 1 例注射部位轻度红斑反应,未出现流感样症状、血小板计数下降及肝肾功能安全信号(非临床研究中的主要毒性反应)。
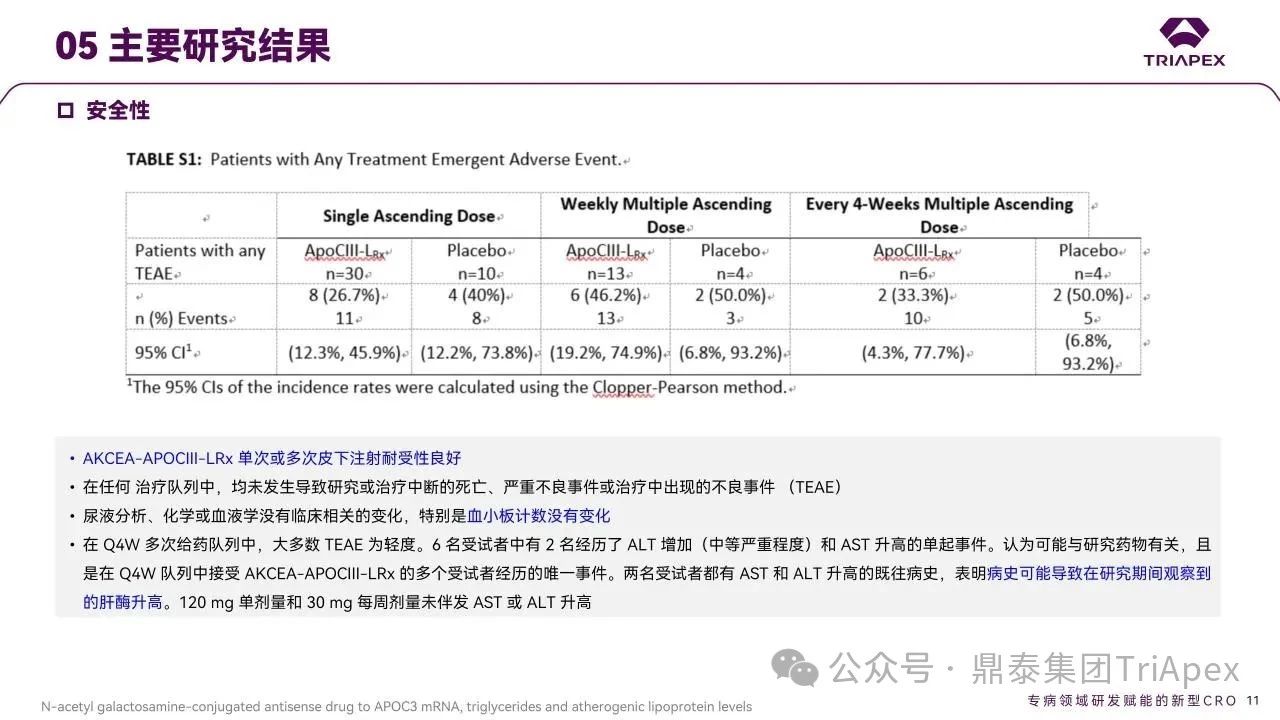
图12. 安全性结果
以上结果表明,靶向肝细胞 ApoC3 mRNA 的抑制剂 AKCEA-APOCIII-LRx 可显著降低 ApoC3、TG 及其他致动脉粥样硬化脂蛋白水平。
2
III期试验(ISIS 678354-CS3)
-核心证据 [NCT04568434]
在本项 Ⅲ 期、双盲、随机试验中,评价了 Olezarsen 在成年 FCS 的患者(且严格低脂饮食 <20 g/天)中相对于安慰剂组的疗效和安全性。该试验于2020年11月至2023年10月期间,在 11 个国家的 29 个中心进行。

图13. Ⅲ 期临床试验设计
研究设计
筛选期结束后,66 名患者以 1:1 的比例随机分配接受 80 mg 或 50 mg 的 Olezarsen 治疗。在每个剂量组内,患者再次以 2:1 的比例被随机分配接受 Olezarsen 或安慰剂;每个剂量组中被分配接受安慰剂的患者组成了安慰剂组。
之前接受过 Volanesorsen 的患者有资格参加试验;所有参与试验的患者在随机分配前至少 1 年内未接受过 Volanesorsen。随机分组时考虑了胰腺炎病史和之前的 Volanesorsen 治疗史。
患者每 4 周接受一次 Olezarsen 或等量的安慰剂皮下注射,持续 49 周。
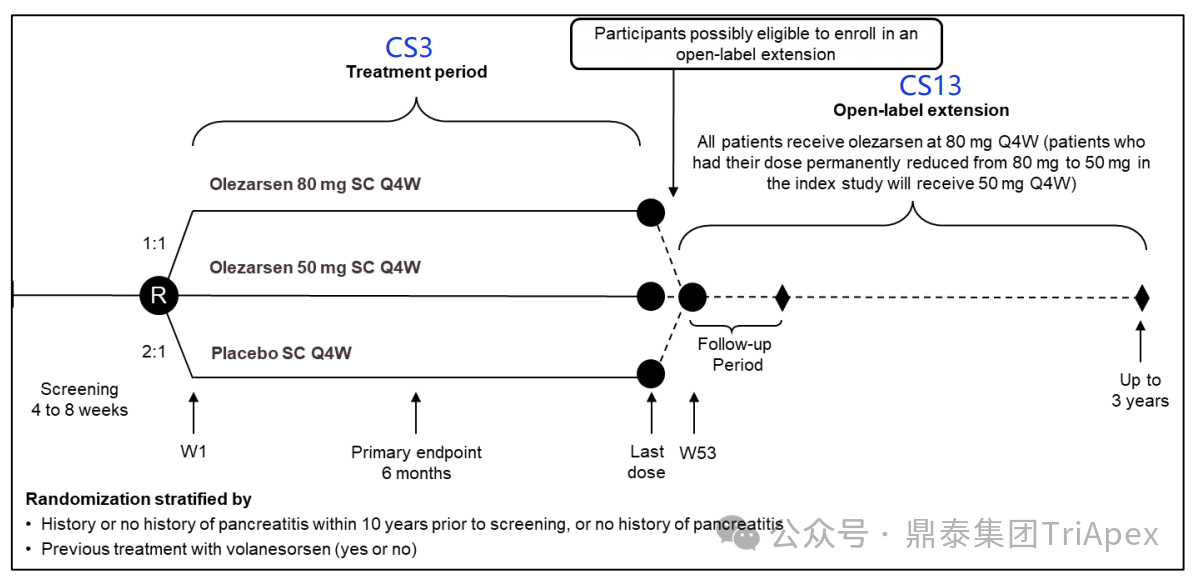
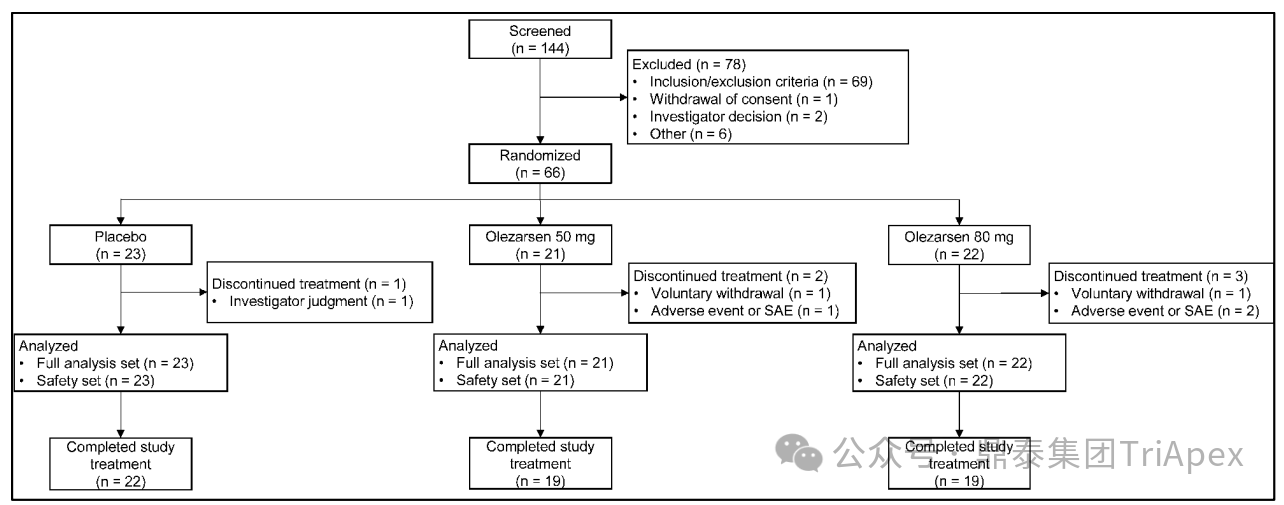
图14. Ⅲ 期试验分组及给药方案
主要终点及结果
试验设定了两个主要终点:
80 mg Olezarsen 组与安慰剂组空腹 TG 水平从基线到 6 个月的变化百分比差异;
以及(如果第一个终点显著)50 mg Olezarsen 组与安慰剂组的变化百分比差异。

图15. Ⅲ 期临床试验目的和试验终点
TG 水平
结果显示,与安慰剂组相比,80 mg Olezarsen 组受试者空腹 TG 水平从基线到 6 个月的百分比变化差异显著,平均降低 43.5%;与安慰剂组相比,50 mg Olezarsen 组结果不显著(平均变化 -22.4%)。
与安慰剂组相比,80 mg Olezarsen 组空腹 TG 水平从基线到 12 个月的平均变化 -59.4 %,50 mg olezarsen 组与安慰剂组之间的差异为 -43.8%。
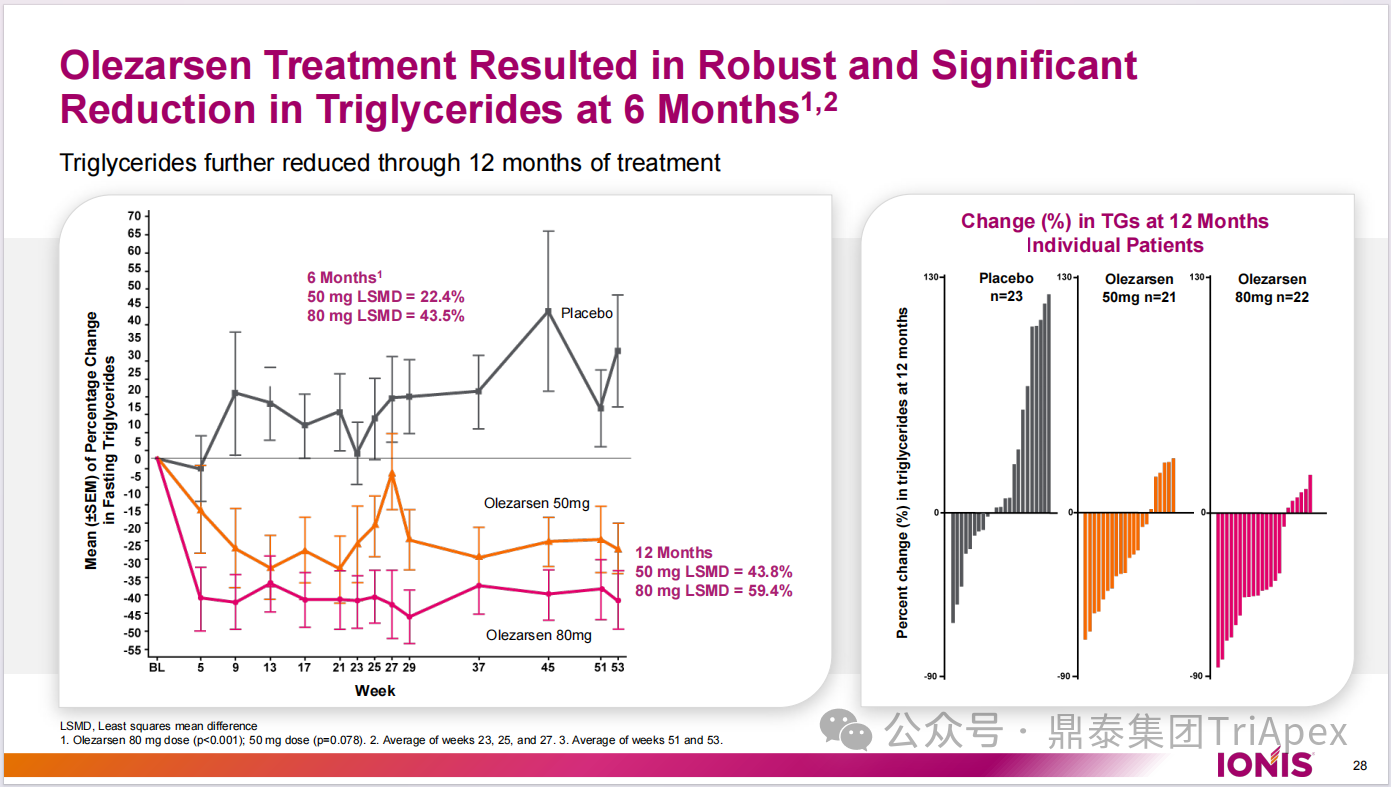
图16. TG 水平变化
关键次要终点及结果
次要终点包括 ApoC3 等水平从基线到 6 个月的平均百分比变化,以及独立评估的急性胰腺炎事件。
ApoC3 水平
与安慰剂组相比,80 mg Olezarsen 组患者空腹 ApoC3 水平从基线到 6 个月的变化为 -73.7% ,从基线到 12 个月变化为 -81.3%;50 mg Olezarsen 组相应值从基线到 6 个月为 -65.5%,从基线到 12 个月为 -77.1%。
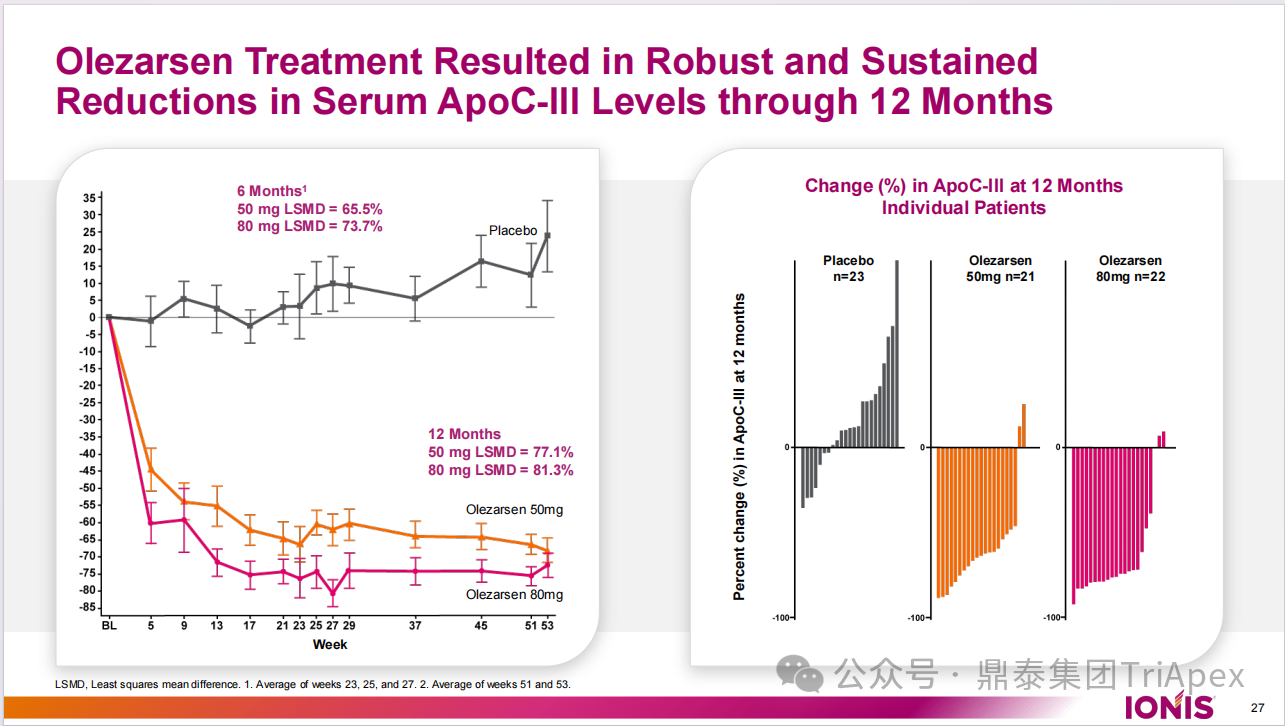
图17. ApoC3 水平变化
胰腺炎事件
在 12 个月的治疗期间,接受 Olezarsen 80 mg 治疗的受试者中,胰腺炎的发生率低于安慰剂组(Olezarsen 80 mg 组有 1 例急性胰腺炎(AP)发生,而安慰剂组有 7 名受试者共经历了 11 例)。
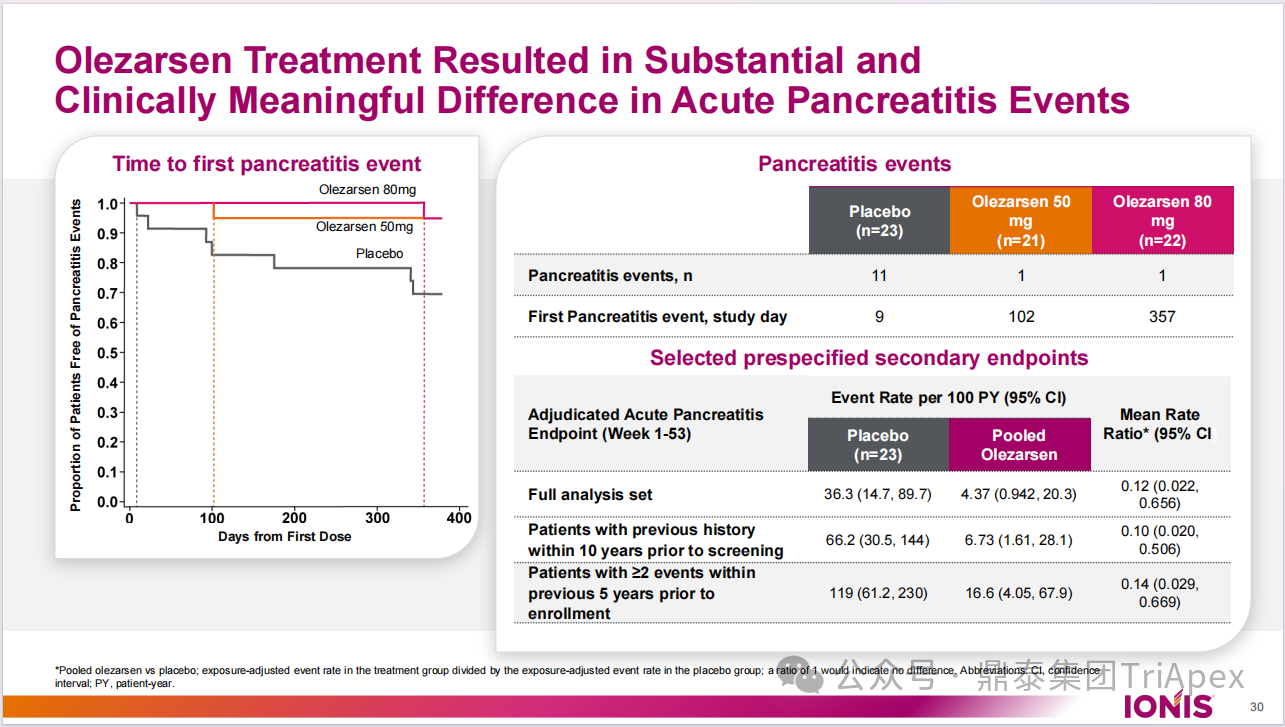
图18. 胰腺炎事件发生情况
安全性评估
安慰剂组患者中 TEAE 和 SAE 更多,主要是由于安慰剂组患者胰腺炎事件发生更多。没有与研究药物相关的严重 TEAE。血小板计数和肝肾功能指标未见有临床意义的改变。轻度注射部位反应发生率低。在 50 mg Olezarsen 组中发生了一例死亡,该事件与研究药物无关。
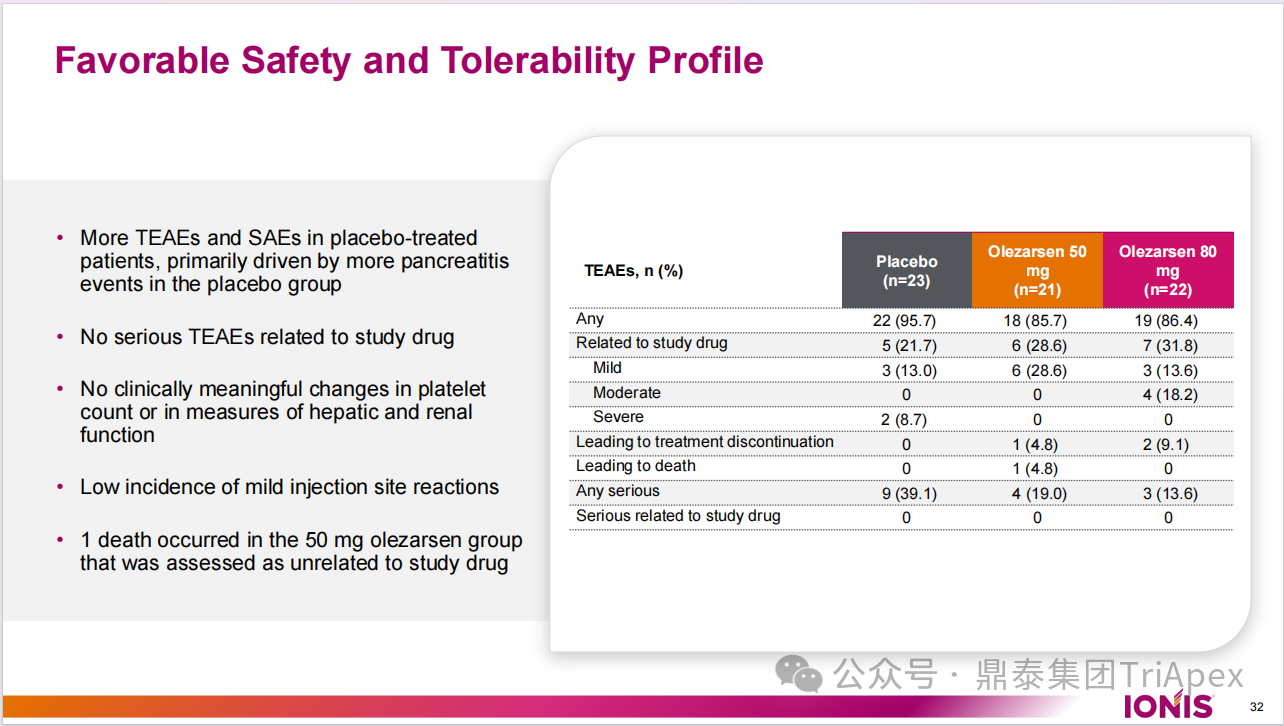
图19. 安全性和耐受性
结论
在 FCS 中,每 4 周皮下注射 80 mg Olezarsen 可显著降低 6 个月时的空腹 TG 水平,且安全性和耐受性良好。

图20. Ⅲ 期临床试验结论
3
Ⅱb期试验(ISIS 678354-CS8)
-支持性证据 [NCT05355402]
Olezarsen 的获批也基于试验 ISIS 678354-CS8 中相关适应症的支持性证据。在这项 Ⅱb 期、随机、安慰剂对照、双盲试验中,评价了 Olezarsen 在正在接受稳定降脂治疗且存在中度 HTG 并伴有心血管风险增加或重度 HTG 的成人患者中的疗效和安全性。

图21. Ⅱb 期临床试验设计
研究设计
符合条件的受试者经过大约 4 周的筛选期,包括至少2周的饮食和生活方式稳定期及约 2 周的资格确认期。资格确认后,154 名符合条件的受试者以 1:1 的比例被随机分配至队列 A(50 mg)或队列 B(80 mg),每个队列再以 3:1 的比例随机分配接受 Olezarsen 或安慰剂治疗,为期 53 周。队列 A 的患者在治疗期的 1~49 周内,每四周一次接受 50 mg Olezarsen 或等量的安慰剂。队列 B 的患者在治疗期的 1~49 周内,每四周一次接受 80 mg Olezarsen 或等量的安慰剂。
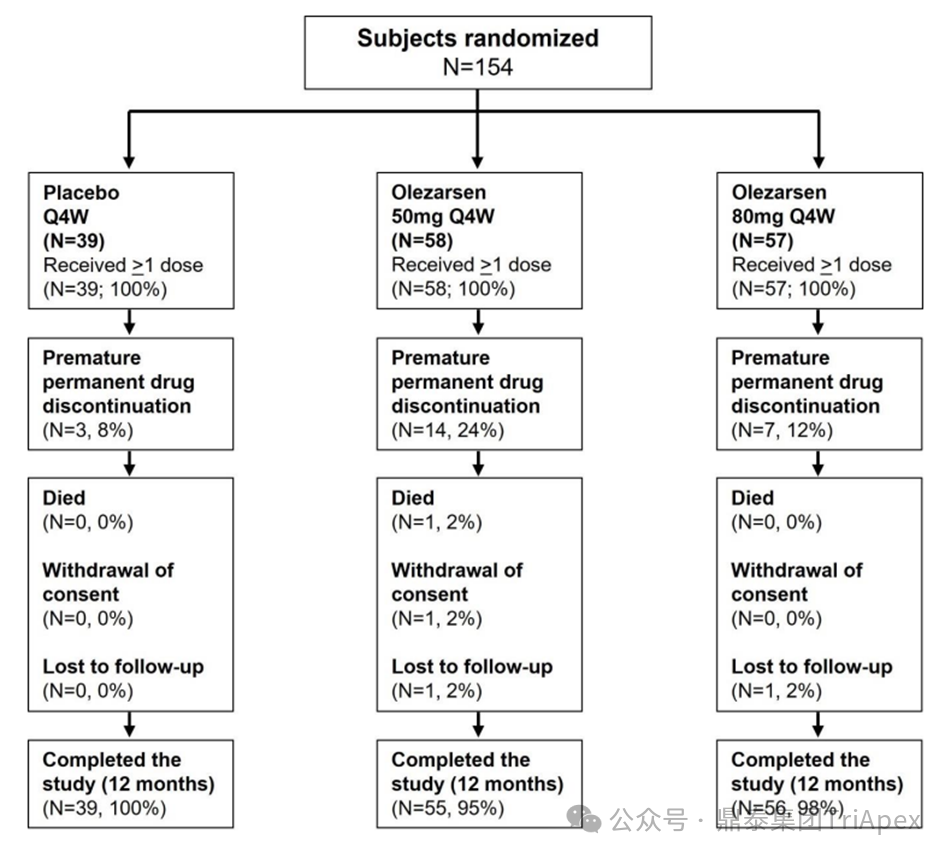
图22. Ⅱb 期临床试验分组及给药方案
主要终点和次要终点
主要终点为从基线至 6 个月时 TG 水平的百分比变化。次要终点包括 6 个月时 ApoC3、VLDL-C、LDL-C、non-HDL-C、ApoB 的变化;12 个月时的脂质水平变化;基线时中度高 TG 血症患者在 6 个月和 12 个月时 TG 水平低于 150 mg/dL(通常认为是正常参考值的临界值)的比例;以及胰腺炎事件。

图23. Ⅱb 期临床试验目的及试验终点
TG 水平
在 6 个月时,安慰剂组患者 TG 水平较基线平均降低 7.8% , Olezarsen 50 mg 组患者平均降低 57.1%,80 mg 组患者平均降低 60.9%。与安慰剂相比, 2 个 Olezarsen 剂量组的 TG 水平均显著降低。此外,Olezarsen 对 TG 水平的影响在治疗开始后 1 个月便很明显,并持续到 12 个月。
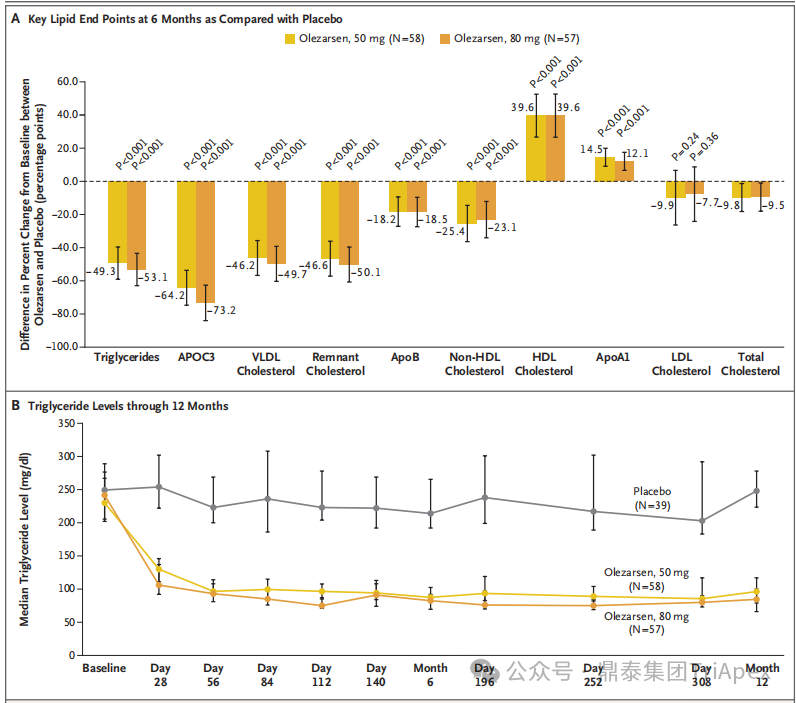
图24. Olezarsen 对 6 个月关键脂质水平和 12 个月 TG 水平的影响
ApoC3 水平
与安慰剂组相比,50 mg Olezarsen 组相对于基线的百分比变化为降低 64.2%,80 mg 组为降低 73.2 % 。
其它指标
与安慰剂组相比,Olezarsen 2 个剂量组的 VLDL-C、残余胆固醇、non-HDL –C 和 ApoB 均显著降低;HLDL-C 显著升高
胰腺炎事件
在 128 名基线患有中度 HTG 且 6 个月时 TG 数据完整的患者中,6 个月时 TG 水平低于 150mg/dL 的达标情况如下:
50 mg Olezarsen 组 49 例患者中有 42 例达标(86%)
80 mg Olezarsen 组 45 例患者中有 42 例达标(93%)
安慰剂组 34 例患者中仅有 4 例达标(12%)
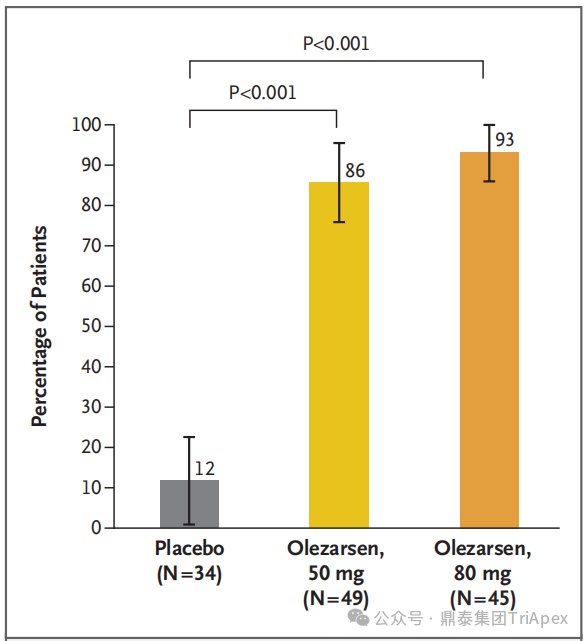
图25. 基线时中度 HTG 且 6 个月时 TG 水平正常的患者
安全性评估
在接受 Olezarsen 或安慰剂治疗期间至末次给药后 28 天内发生不良事件的患者比例相似。共 13 例患者(8%)报告了严重不良事件,均与 Olezarsen 或安慰剂无关。
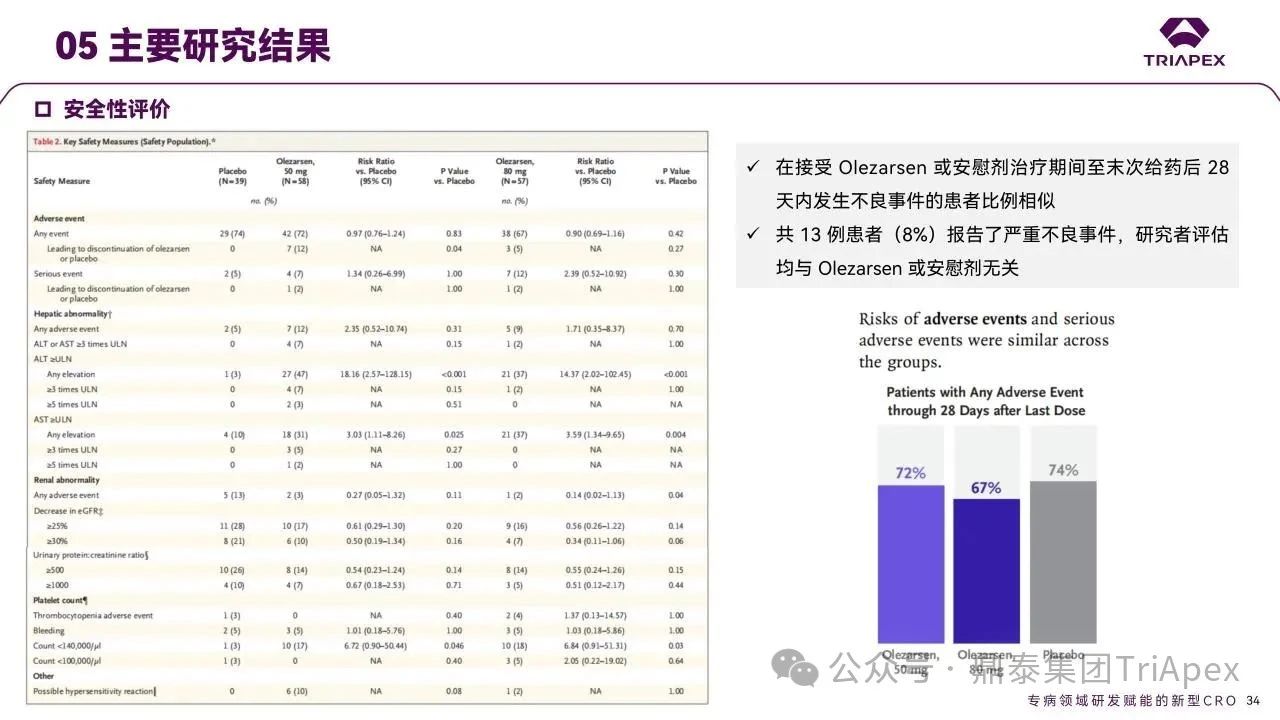
图26. 安全性评价结果
结论
在伴有中度 HTG 和心血管风险升高的患者以及伴有 sHTG 的患者中,与安慰剂相比,每月注射 Olezarsen 可使 TG 水平在 6 个月内显著降低。
尽管上述试验的样本量均不大,但是试验比较具有说服力,对主要终点指标 TG 表现出显著的治疗获益,并在作为次要终点的脂质指标中表现出积极的改善的。
Olezarsen 非临床研究内容
及与临床的相关性
药理学
申请人通过体外和体内研究证实了 Olezarsen 的药理活性:
采用原代肝细胞(人及转基因小鼠)进行的体外试验
Olezarsen 可使 ApoC3 mRNA 较未处理对照组降低达 89%。
在野生型小鼠、转基因小鼠以及食蟹猴中开展的体内试验
Olezarsen 可剂量和时间依赖性地降低肝脏 ApoC3 mRNA、血浆 ApoC3 蛋白及 TG 水平,符合预期药理特性。
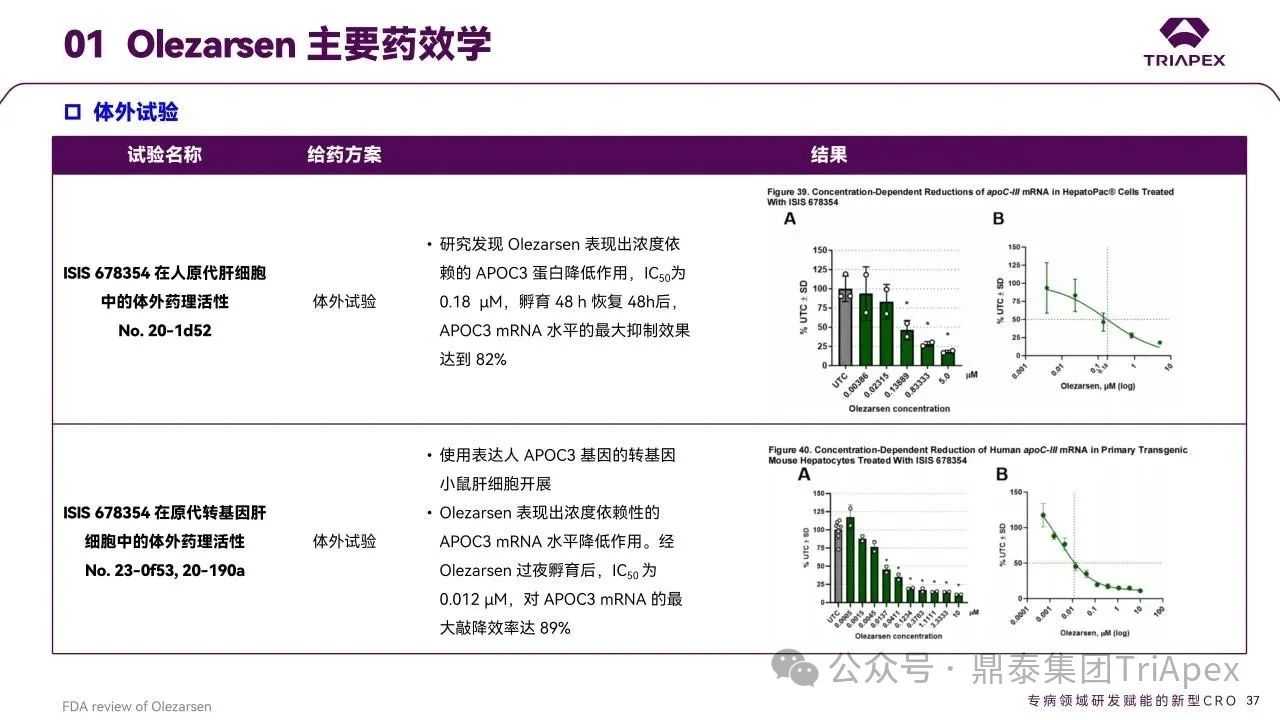
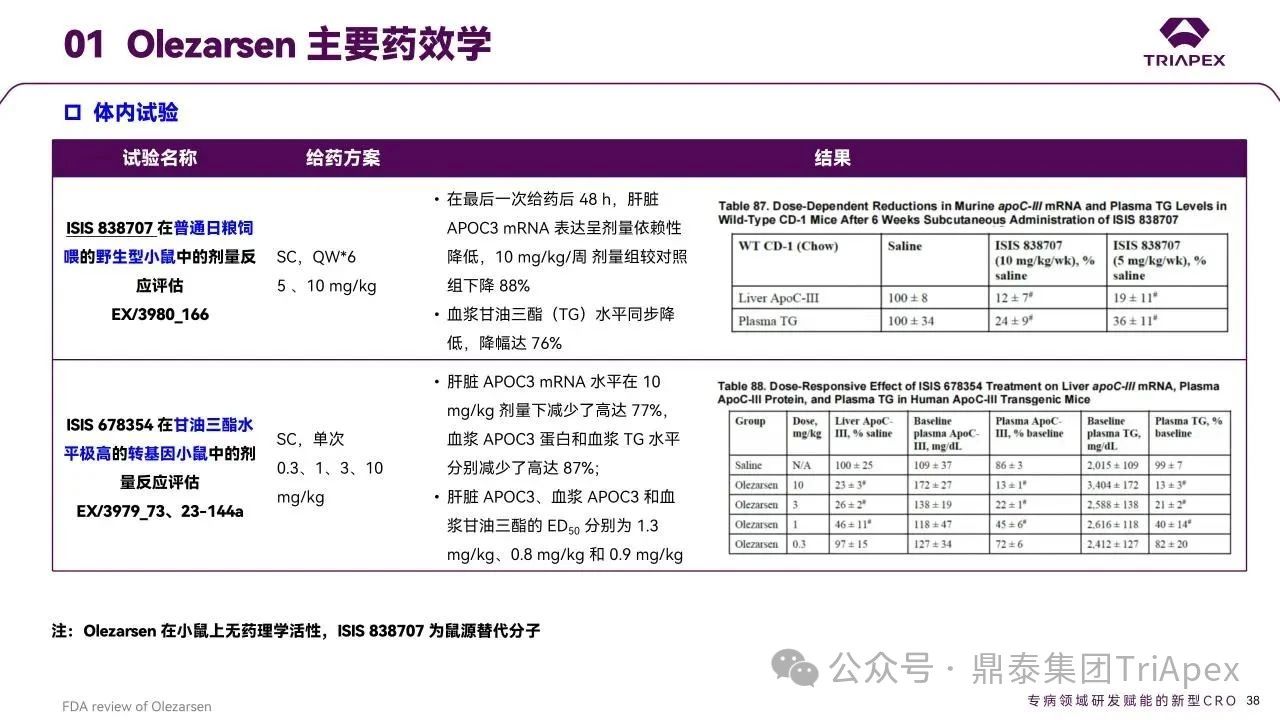
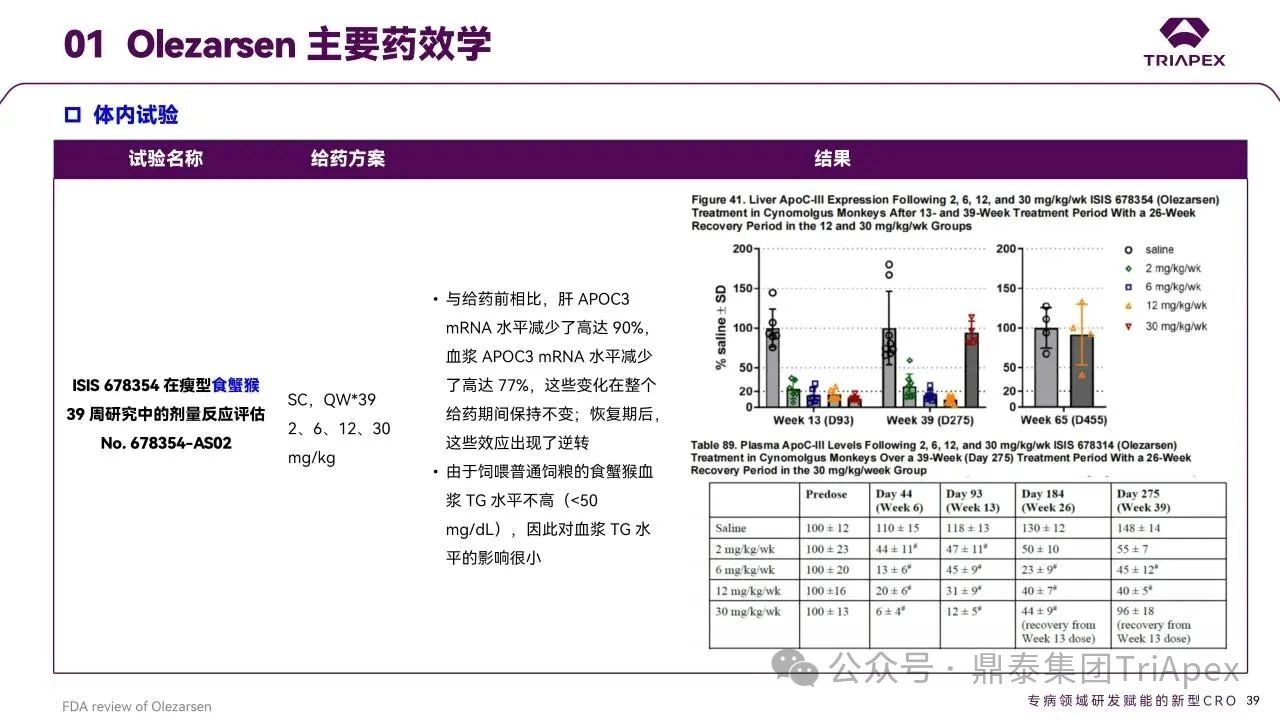
图27. Olezarsen 主要药效学
动物模型研究结果提供了合理的概念验证,并为后来的临床试验提供了具有转化价值的监测指标(血浆 TG),详见上文。

图28. 非临床研究与临床试验相关性分析
在该产品的 FDA 审评报告中,将 CYP450 诱导、转运体研究等内容放在了次要药效学部分,这有别于其他获批的产品的常见做法(通常是脱靶效应评估)。
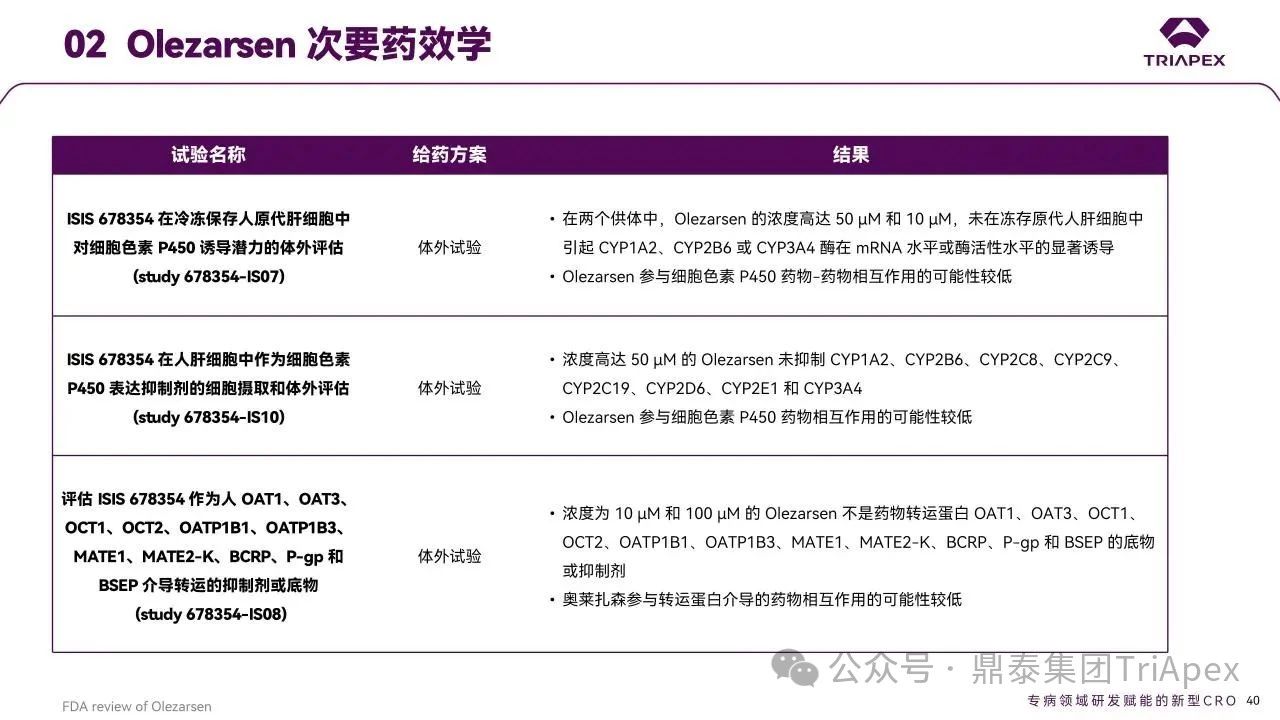
图29. Olezarsen 次要药效学
安全药理学部分较罕见地开展了 hERG 试验,同时开展了单独的猴安全药理学试验。当然,不出意外地均为阴性结果。

图30. Olezarsen 安全药理学
药代动力学
Olezarsen 的非临床 PK/TK 参数(包括吸收、分布、代谢和排泄特征)通过以下研究进行了充分表征:小鼠和食蟹猴单次给药药代动力学试验及在小鼠重复(6 周、13 周和 26 周)毒性试验和食蟹猴 39 周重复给药毒性试验中伴随的毒代试验。
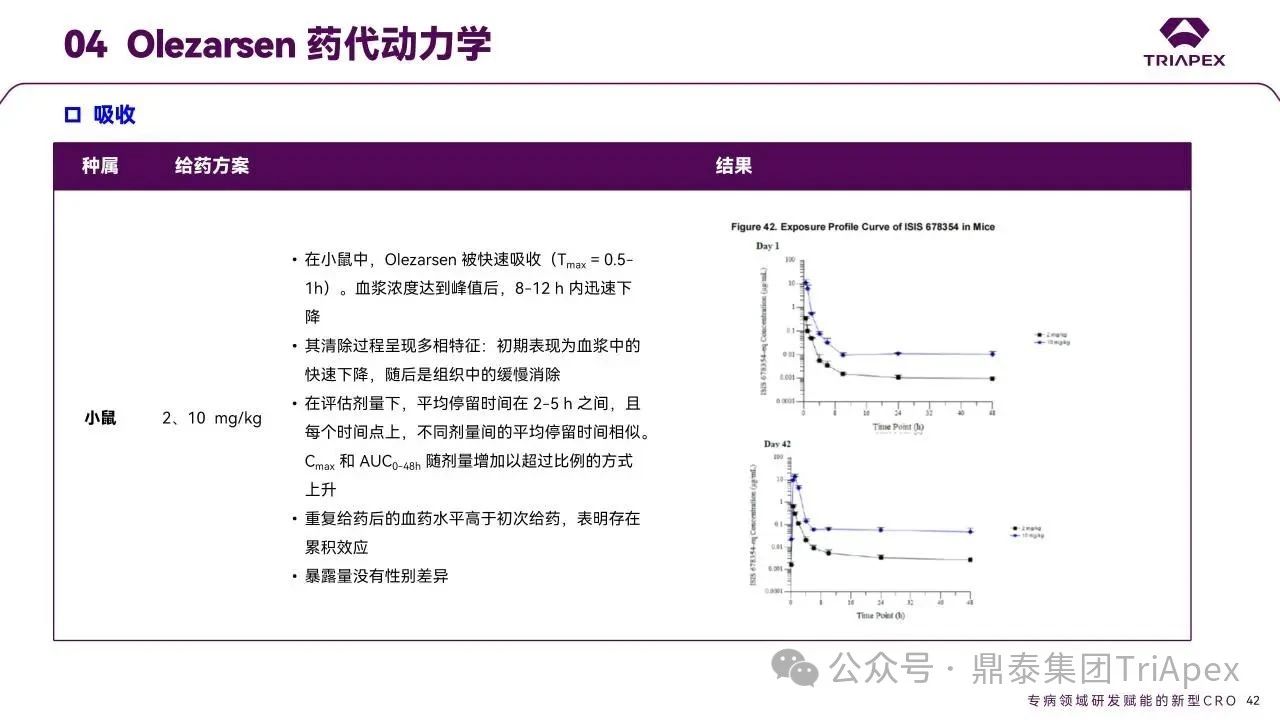
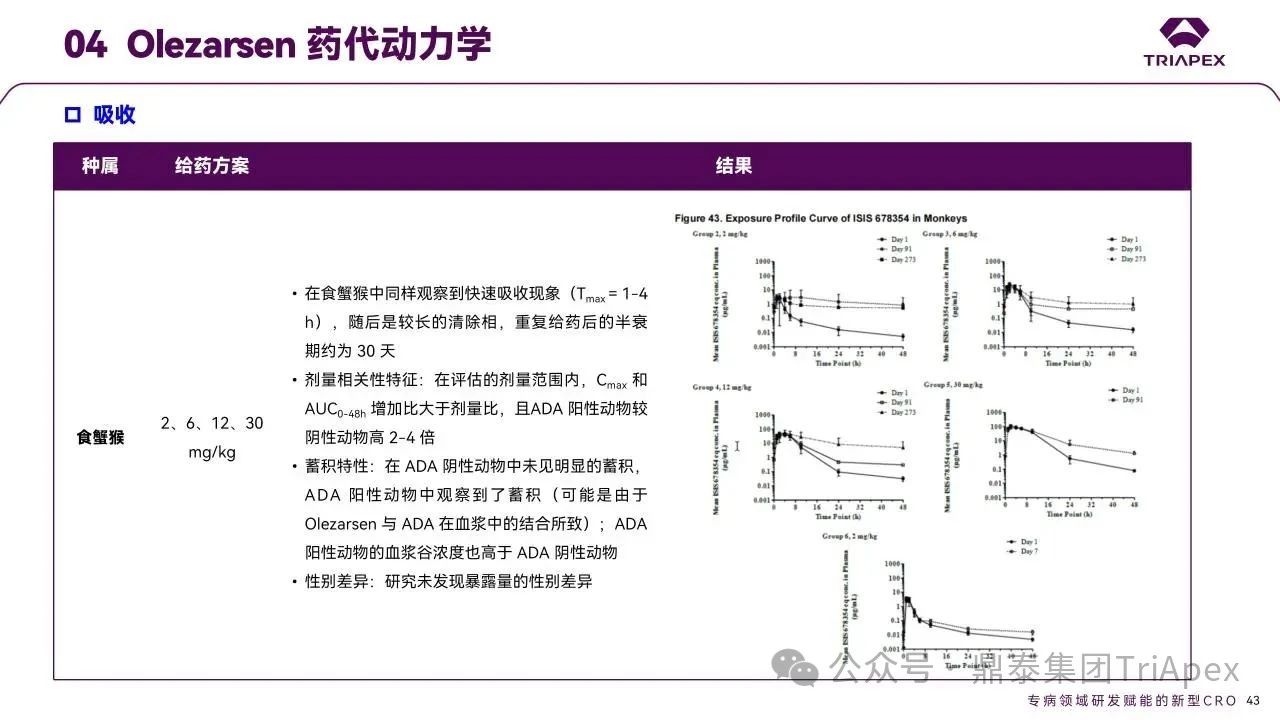
图31. Olezarsen 药代动力学
与临床研究结果对比发现,猴 PK 特征可预测人体 PK 特征。
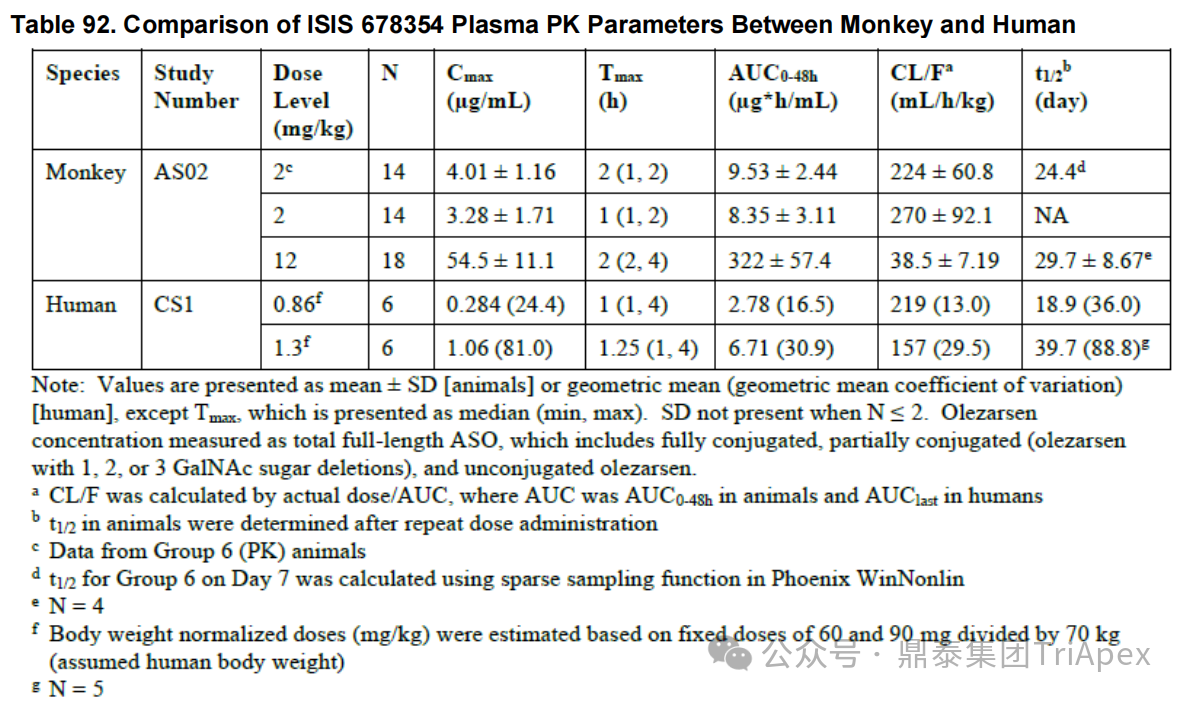
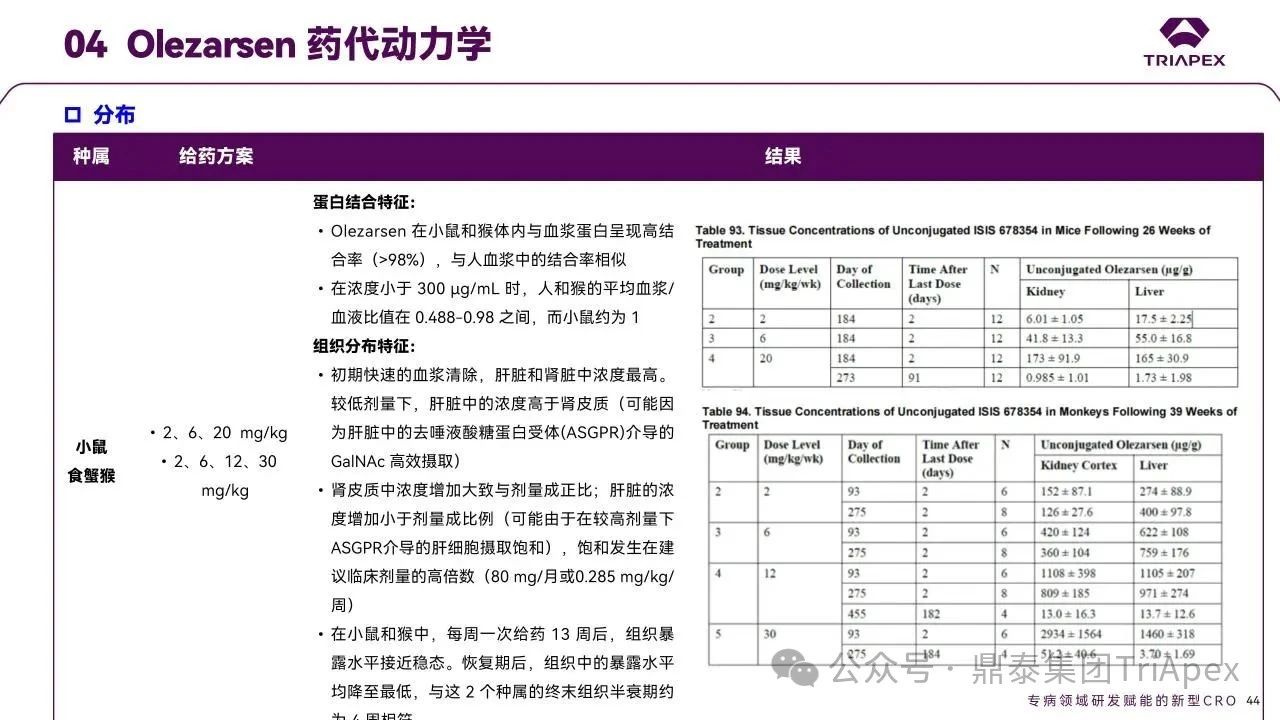


图32. Olezarsen 药代动力学
毒理学
通过以下研究阐明了 Olezarsen 的毒理学特征:重复给药毒性试验(小鼠、食蟹猴)、生育力与早期胚胎发育研究(小鼠)、一系列体外和体内遗传毒性研究以及杂质界定研究。其活性成分非偶联 ASO(Volanesorsen)的胚胎-胎仔发育毒性、围产期发育毒性和致癌性已在此前该产品的上市申请中完成评估。经与监管机构沟通,这些针对非偶联 ASO 的研究结果可支持本次申请。
★ 重复给药毒性试验
Olezarsen 的一般毒性特征通过 CD-1 小鼠(26 周)和食蟹猴(39 周)的重复给药毒性研究(每周一次,皮下注射)进行评估,两项试验分别设置了 13 周和 26 周的恢复期观察(关键毒理学参数包括 NOAEL、判定依据及基于 BSA 的安全窗)。研究结果显示,该药物在肝脏、肾脏和脾脏中产生了符合硫代磷酸酯骨架 ASO 预期毒性的相关效应,同时观察到注射部位组织反应,其中最需关注的毒性反应是在 NHP 中出现的 1 例血小板减少症。结合前文,在临床试验中,具有临床意义的肝肾功能异常或血小板异常较为罕见。
【安全窗】
人临床剂量为 80 mg/月,按成年人体重 60 kg计算,约为 1.33 mg/kg,按照 BSA 法折算后约为 49 mg/m2。
大鼠 NOAEL 为 2 mg/kg/周,按照 BSA 法折算后约为 6 mg/m2,累计剂量为 24 mg/ m2/月,安全窗只有约 0.5 倍。
猴 NOAEL 为 6 mg/kg/周,BSA 折算后约为 72 mg/m2,累计剂量为 288 mg/ m2/月,安全窗约 6 倍。
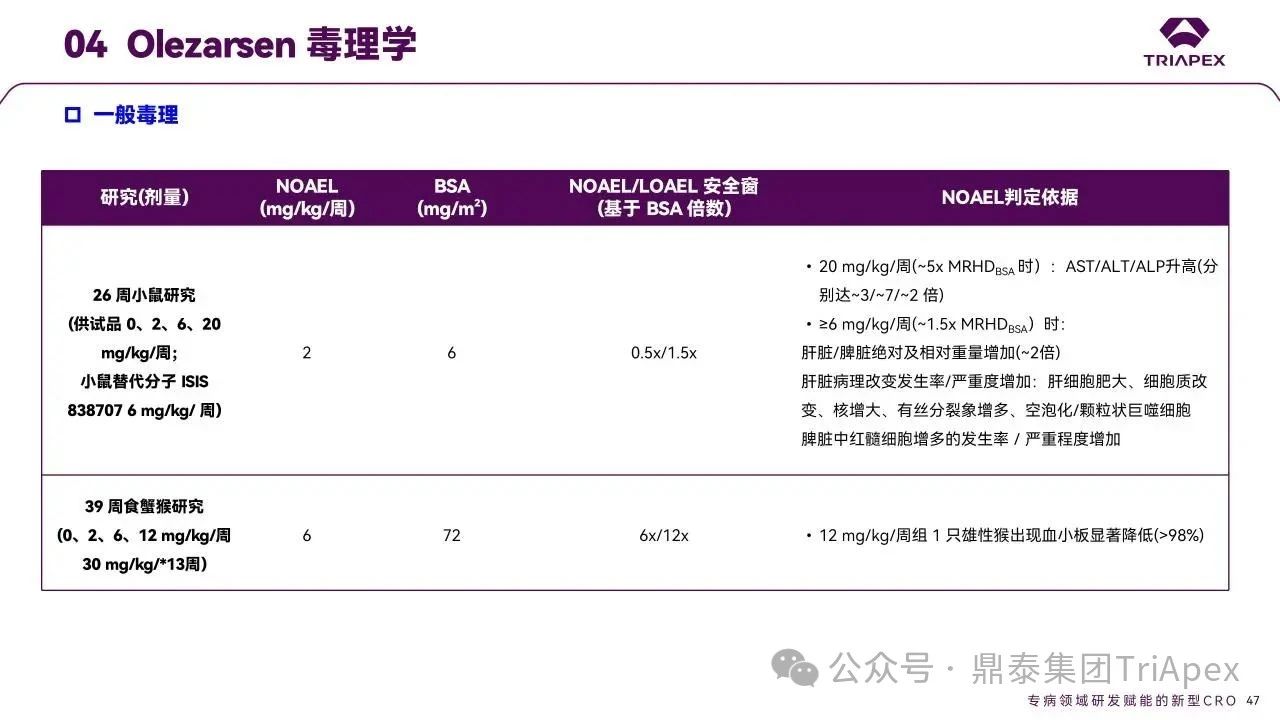
图33. Olezarsen 一般毒理
★ 遗传毒性试验
Olezarsen 的遗传毒性评估包括:Ames 细菌回复突变试验、CHL 细胞染色体畸变试验和 CD-1 雄性小鼠骨髓微核试验。结果显示,Olezarsen 在所有试验系统中均未显示遗传毒性。
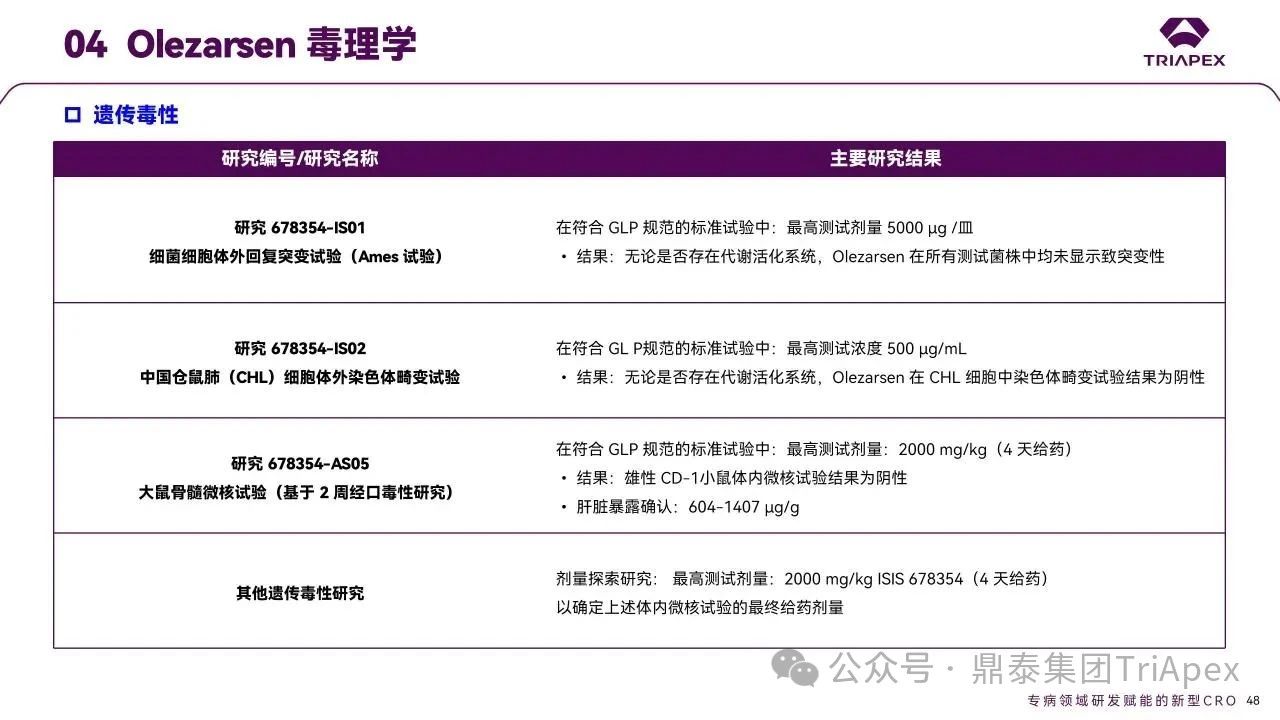
图34. Olezarsen 遗传毒性
★ 生殖毒性试验
鉴于 Volanesorsen 在生育力/胚胎-胎仔发育毒性试验中观察到雄性生殖系统影响的改变(前列腺/精囊重量减轻和精子数量减少),针对 Olezarsen 开展了一项符合 GLP 规范的生育力与早期胚胎发育研究(CD-1 小鼠)。结果显示,在最高剂量为 MHRD 暴露量 2 倍的剂量下未见对生育力和胚胎发育的影响。
由于在 Volanesorsen 的相关研究未见对胚胎-胎仔发育和围产期发育参数的影响,故未对 Olezarsen 进行上述研究。
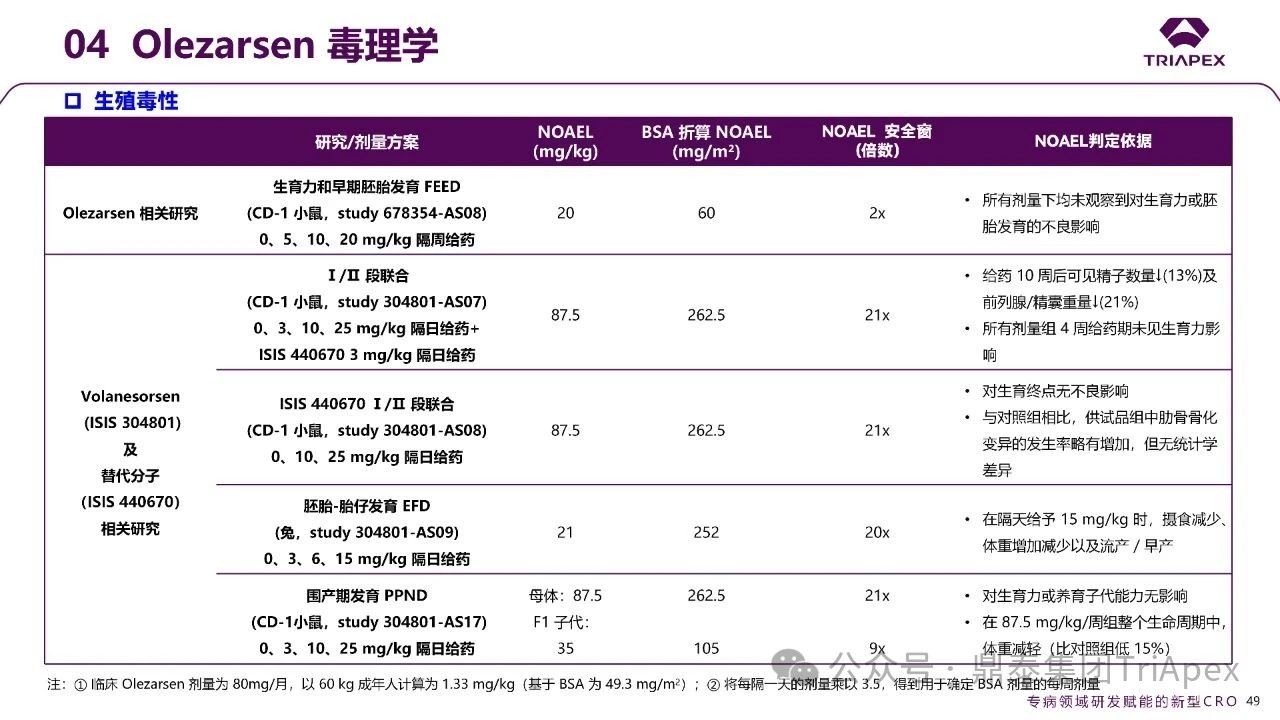
图35. Olezarsen 生殖毒性
★ 致癌性试验
未直接开展 Olezarsen 的致癌性研究,主要依据可能是在此之前已通过 Volanesorsen 在 CD-1 小鼠和 SD 大鼠中完成了两年期致癌性评估。
研究显示,两种啮齿类动物肿瘤发生率均有所上升,但主要与硫代磷酸酯寡核苷酸类化合物的促炎特性及给药方式相关,故临床相关性有限。值得注意的是,肝细胞癌、恶性纤维组织细胞瘤、血管肉瘤和组织细胞肉瘤在其他 ASO 的致癌性研究中亦有报道,进一步证实这些肿瘤可能是硫代磷酸酯寡核苷酸的类效应(Class Effect)。

图36. Olezarsen 致癌性
★ 杂质界定相关研究
Olezarsen 的杂质界定通过两项研究完成安全性评估:一项为期 13 周的小鼠杂质界定研究(2 个批次样品,每个批次 2 个剂量组),以及一项为期 39 周的猴重复给药毒性研究。结果表明,在相同的给药剂量下,含有不同杂质水平的样品,安全性特征类似,肝脏中药物浓度相当。通过该试验,申请人认为原料药质量标准中制定的杂质限度符合要求。

图37. Olezarsen 其他研究
免疫原性
相信关于免疫原性是否检测,以及如何评估是业界普遍关心的问题。本文也对非临床和临床研究中 ADA 的产生情况及其对于暴露量、安全性和有效性的影响进行了评估。
在食蟹猴药代试验中,暴露量增加比例高于剂量比例,且 ADA 阳性动物较阴性动物高 2~4 倍,ADA 阳性动物血浆谷浓度也显著升高。此外,ADA 阳性动物出现药物蓄积现象(可能是由 Olezarsen 与 ADA 在血浆中的结合所致),阴性动物未见明显蓄积。
在食蟹猴重复给药毒性试验中,给药组动物(30-64%)及对照组(22%)均检测到 ADA 产生。经 3 个月或更长周期给药后,ADA 阳性动物的血浆谷浓度较阴性动物升高约 6 倍,提示药物可能与血浆中的 ADA 结合。值得关注的是,是否产生 ADA 并未导致肝脏等组织药物浓度的显著差异,且对毒性特征(包括肝毒性指标)及药效学终点(肝脏 ApoC3 mRNA 水平)均无显著影响。
在临床研究中,Olezarsen 治疗可导致约 40% 的受试者出现 ADA。随着治疗时间延长,ADA 发生率可能进一步增加,这一点在开放标签扩展研究(CS13)的受试者中得到了证实。对 CS3 和 CS8 研究期间 AE 的免疫原性数据回顾分析显示,包括超敏反应在内的 AE 与 ADA 状态之间无明确相关性。然而,在 CS13 研究中,与 ADA 阴性受试者相比,ADA 阳性受试者的注射部位反应(ISRs)和超敏反应更为频繁,但由于样本量较小,尚无法确定明确的因果关系。
FDA 审批决策依据
通常,FDA 需要两个充分且控制良好的临床试验来满足规定的实质性证据要求。然而,鉴于 FCS 疾病的罕见性、严重性、治疗该疾病未满足的医疗需求、ISIS 678354-CS3 试验结果的说服力以及在中度或重度 HTG 受试者中的确证性证据的稳健性,认为申请人已提供了满足要求的实质性证据substantial evidence of effectiveness(SEE)。
尽管该申请主要依赖于一项安慰剂对照试验,但其结果在这一严重且罕见的疾病中具有显著疗效,并且该疾病的自然病程已得到充分描述。该申请支持将 Olezarsen 以每月 80 mg 皮下注射的方式,作为低脂饮食的辅助治疗,用于成人 FCS 患者的治疗。

监管互动
Olezarsen 的快速上市历程充分展现了创新药物研发中监管科学的重要性。通过与 FDA 等监管机构建立早期且持续的沟通机制,在关键环节实现高效互动。
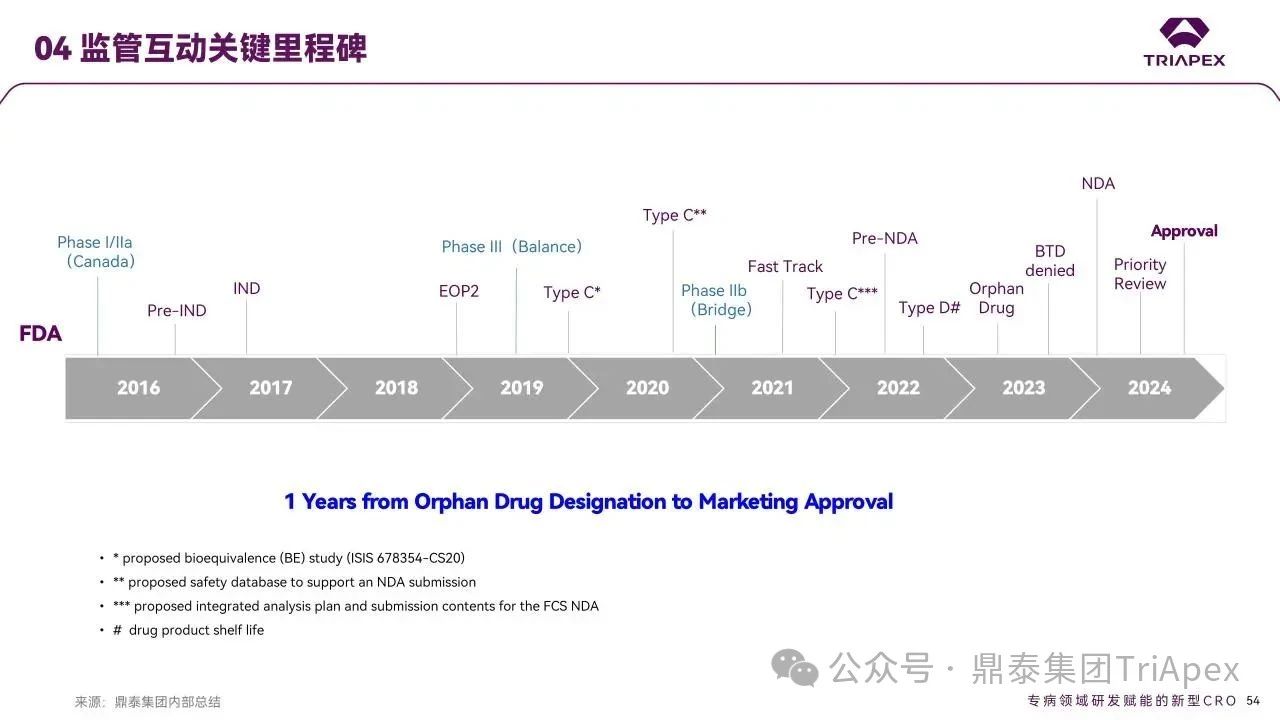
图38. 监管互动关键里程碑
重要监管里程碑
IND阶段
2017年12月14日:提交初始 IND 136692 申请
2018年1月16日:FDA 发布无暂缓意见的临床/非临床建议函,确认试验可安全推进
快速通道认定
2022年12月22日:提交 FCS 治疗的快速通道(Fast Track)资格申请
2023年1月19日:获 FDA 授予快速通道资格(用于降低成人 FCS 患者 TG 水平)
2023年9月13日:提交商品名“Tryngolza”审核申请
2024年3月11日:商品名获条件性认可通知书
突破性进展
2024年1月18日:提交突破性疗法(Breakthrough Therapy)认定申请
2024年2月14日:获孤儿药资格认定
2024年2月20日:获突破性疗法认定(饮食辅助降低 FCS 患者 TG)
2024年4月19日:提交 NDA 218614申请(适应症:饮食辅助降低成人 FCS 患者 TG)
2024年6月18日:获优先审评资格
关键会议沟通
pre-IND 会议(B类)
2017年9月1日: 提交 B 类临床前会议申请(Pre-IND Meeting)
核心议题:评估非临床与临床开发计划的充分性,以支持 IND 申请
2017年10月31日:监管机构签发正式书面回复(Written Responses)
EOP2 会议(B类)
2020年4月17日:申请人提交 EOP2 申请,拟议讨论 FCS 治疗开发计划
2020年4月28日:FDA 签发《会议批准函》,指出 EOP2 会议请求为时过早("premature"),将改为通过 C 类书面回复形式进行沟通
2020年5月15日:申请人提交会议材料包,包含:Ⅲ 期临床试验方案ISIS 678354-CS3(标题:A Randomized, Double-Blind, Placebo-Controlled, Phase 3 Study of AKCEA-APOCIII-LRX (ISIS 678354) Administered Subcutaneously to Patients with Familial Chylomicronemia Syndrome (FCS))
2020年7月1日:FDA 书面回复:FDA 对该项目进入 Ⅲ 期开发的充分性存在担忧,并就计划的 Ⅲ 期试验提供一般性初步意见和获取额外数据的建议
pre-NDA 会议
2023年9月27日:申请人请求召开 pre-NDA 会议,该会议获批准并拟定于2023年12月12日举行
2023年12月6日:FDA 发布初步意见,其中包含对 FCS NDA 申报材料内容与格式的反馈意见。申请人认可该初步意见内容,并取消了此次会议
同类产品研究进展
围绕 ApoC3 靶点的竞争始终没有停止过。鼎泰团队汇总了目前在研的 ApoC3 药物,包括 siRNA、单抗等。
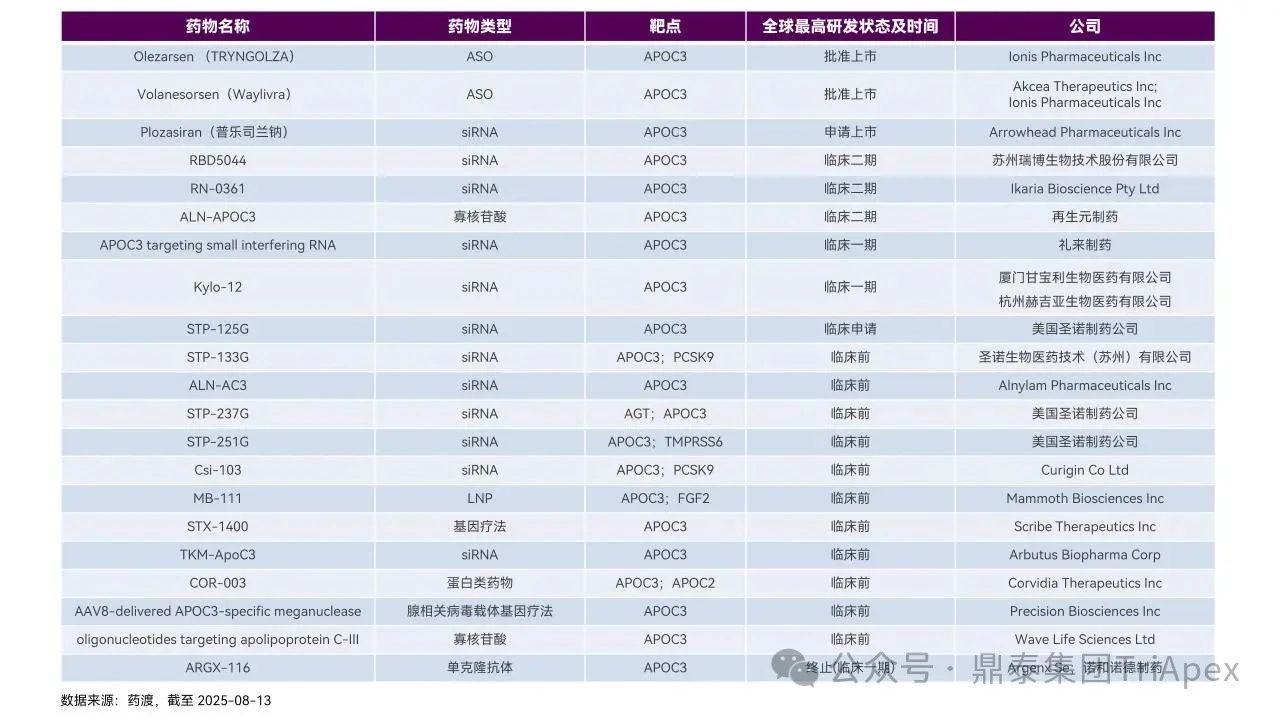
图39. 截至目前在研的 ApoC3 药物
在上述产品中,进展较快的是 Plozasiran。Plozasiran(ARO-APOC3)是由 Arrowhead Pharmaceuticals 开发的靶向 ApoC3 的 siRNA。在多项临床研究中,Plozasiran 显示可降低 FCS、sHTG 和混合性高脂血症患者的 TG 和多种致动脉粥样硬化脂蛋白,且显示出良好的安全性。
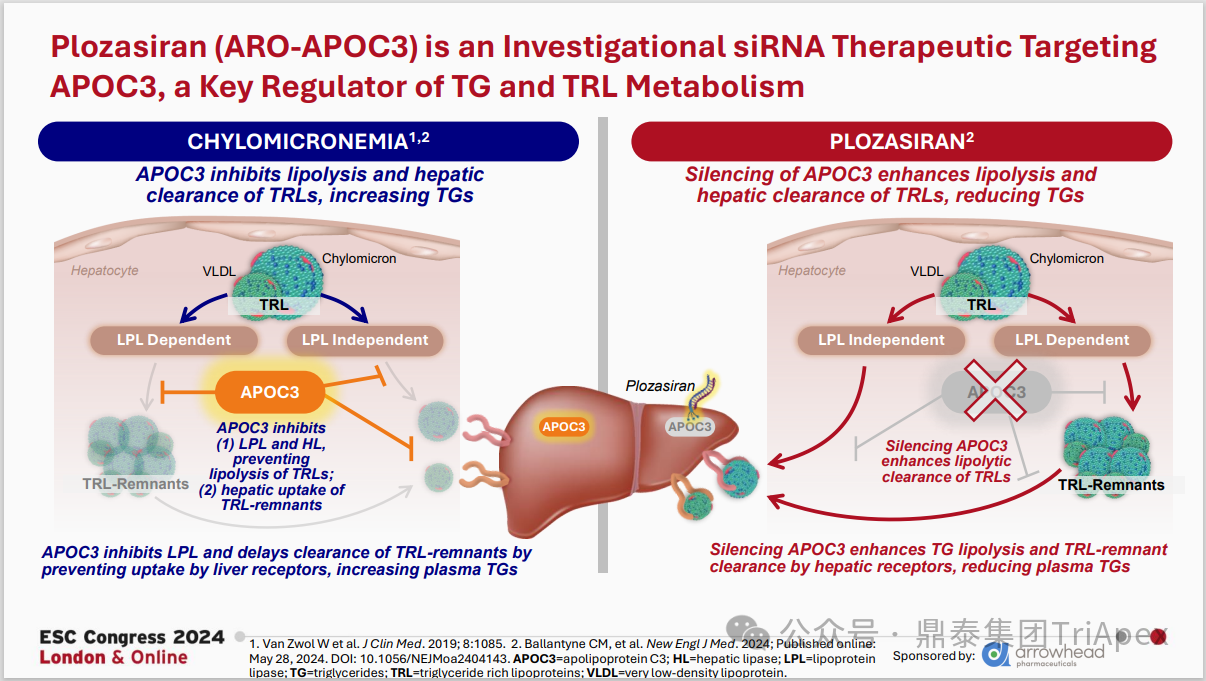
图40. Plozasiran 作用机制
产品最新进展
2015年1月,Arrowhead 宣布 FDA 已接受 Plozasiran 用于治疗 FCS 的 NDA,处方药使用者付费法案 (PDUFA)日期为 2025 年 11 月 18 日,并表示目前不打算召开咨询委员会会议。

图41. 国外研究进展
此次 NDA 提交的临床基础包括 Ⅲ 期 PALISADE 研究的积极证据,以及 Ⅱ 期 SUMMIT 临床研究的支持性验证证据。PALISADE 成功达到其主要终点和多项关键次要终点,包括 TG、ApoC3 和急性胰腺炎发病率的统计学显着降低。
同月, NDA(受理号:JXHS2500018)也获 NMPA 正式受理(由 Arrowhead、Ajinomoto Althea 和维亚臻共同提交),用于治疗 FCS。


图42. 国内研究进展
结语
作为 FDA 批准的首个靶向 ApoC3 的 ASO 药物,Olezarsen 通过显著降低 TG 和富含 TG 的脂蛋白水平,为 FCS 等严重高甘油三酯血症患者提供了治疗选择。其从非临床到临床的开发过程,包括转基因动物模型验证和可临床转化的终点指标,充分展现了转化科学的价值。目前,Olezarsen 的适应症正拓展至更广泛的 HTG 患者群体。作为 FDA 首个靶向 ApoC3 的 ASO 药物,其成功不仅填补了治疗空白,更为代谢性疾病领域的 RNA 靶向治疗迈出重要一步。
与此同时,siRNA 药物 Plozasiran(ARO-APOC3)的 NDA 申请已获得 FDA 和 NMPA 受理,其每 3 个月 25 mg 的给药方案和 80% 的 TG 降幅(PALISADE 研究)展现了更优的治疗潜力。代谢性疾病领域其他创新靶点如 ANGPTL3 也取得重要进展(如 Zodasiran),通过双重调控 LPL 和内皮脂肪酶(EL)活性,为对传统治疗无应答的患者提供新选择。这些突破共同推动着血脂管理进入多靶点精准治疗新时代,并为高血脂等代谢性疾病的治疗开辟了新途径。未来,创新靶点发现和药物设计将继续推动代谢性疾病治疗领域的突破。