
2025-08-20 10:16:57来源:鼎泰集团TriApex浏览量:641
全文共:10420 字 37 图
预计阅读时长:30 分钟
在往期他山之石栏目中,鼎泰团队对已上市的 6 款 siRNA 药物的上市历程、临床开发路径,以及临床前到临床转化的关键环节与科学考量进行了深度复盘与分析,欢迎感兴趣的读者点击下方链接获取详情:
Patisiran(Onpattro®,点击查看原文)
关键词:ATTR-PN;TTR;LNP-siRNA
Givosiran(Givlaari®,点击查看原文)
关键词: AHP;ALAS1;首个 GalNAc-siRNA
Lumasiran(Oxlumo®,点击查看原文)
关键词:PH1;HAO1;GalNac-siRNA
Inclisiran(Leqvio®,点击查看原文)
关键词: 血脂异常;PCSK9;GalNAc-siRNA
Vutrisiran(Amvuttra®,点击查看原文)
关键词:ATTR-PN;TTR ;GalNAc-siRNA
Nedosiran(Rivfloza®,点击查看原文)
关键词:ATTR-PN;TTR ;GalNAc-siRNA
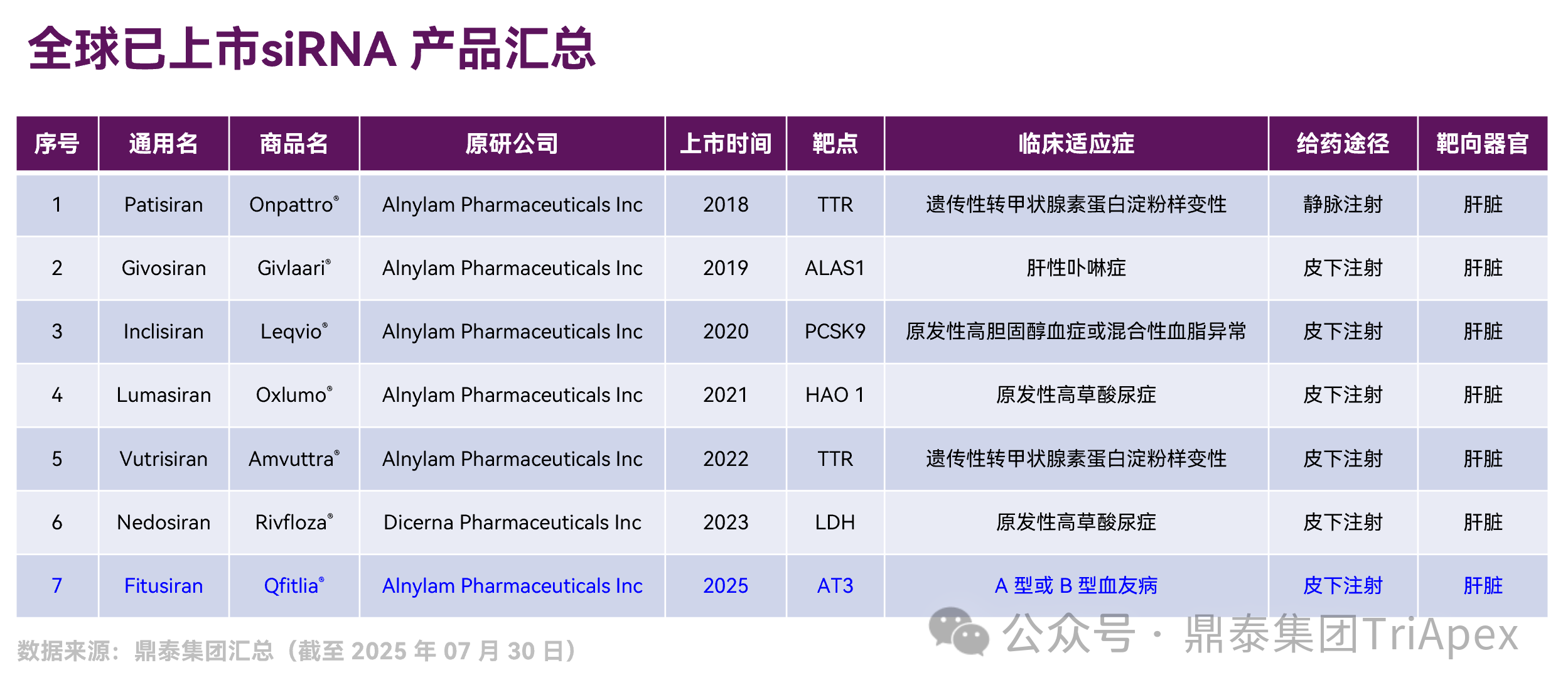
图 1. 全球已上市 siRNA 产品汇总
本期内容将对全球第 7 款获批上市的 siRNA 产品 Fitusiran 进行解析。该药物由 siRNA 领域研发领军企业 Alnylam Pharmaceuticals 联合赛诺菲共同开发,作为 first-in-class 药物,用于 12 岁以上 A 型或 B 型血友病患者出血事件的预防治疗。不同于传统凝血因子替代疗法,Fitusiran 通过 GalNAc 递送系统靶向肝脏抗凝血酶(AT)mRNA,抑制 AT 蛋白合成,从而提升凝血酶生成能力改善止血功能。机制上的另辟蹊径转化为新血友病疾病控制解决方案。对于这样一款具有里程碑意义的产品,其研发路径有很多独到之处,在本期内容中鼎泰团队将对其临床转化及开发路径进行回顾,以期为未来 siRNA 药物研发提供经验积累和技术助力。
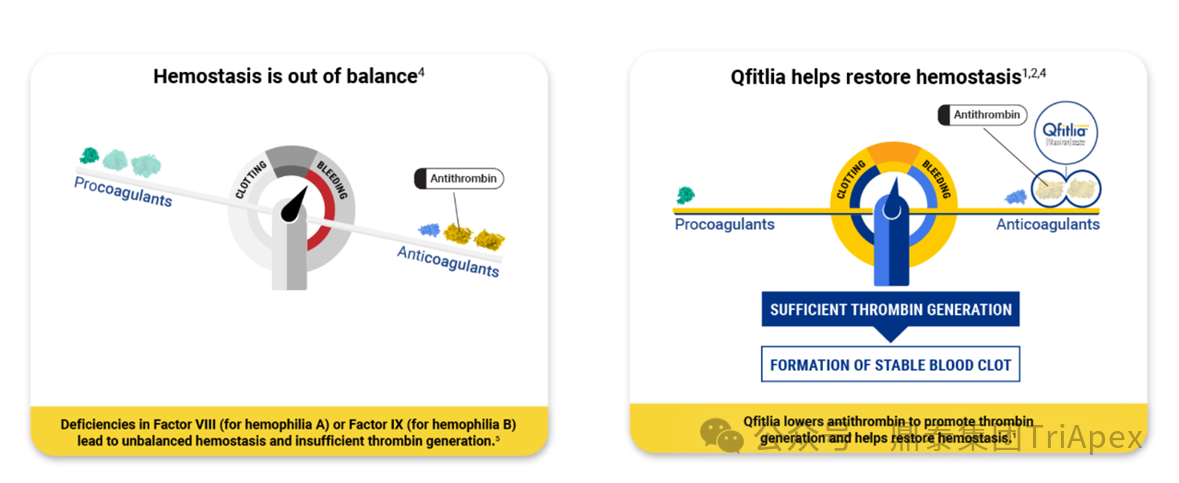
图 2. Fitusiran 能够重新平衡凝血和抗凝血平衡[1]
★ 文章导览 ★
01 | Fitusiran 研发背景 |
02 | 临床开发路径 |
03 | 监管互动里程碑 |
04 | 免疫原性 |
05 | 非临床与临床关联性分析 |
06 | 结语 |
Fitusiran 研发背景
1.1、疾病背景
A 型血友病与 B 型血友病是罕见的X染色体相关隐性遗传病,分别由凝血因子 VIII(FVIII)或凝血因子 IX(FIX)的缺乏引起,疾病的严重程度与 FVIII 或 FIX 水平呈负相关。由于致病基因位于 X 染色体上,血友病患者人群几乎均为男性,女性通常作为单个突变基因的杂合子携带者,仅在部分个体中表现为由 FVIII 或 FIX 水平偏低引起的轻微症状。在生理性凝血过程中,凝血酶最终负责将纤维蛋白原酶解为纤维蛋白单体,纤维蛋白单体随后交联形成稳定的纤维蛋白凝块,实现有效止血。凝血酶的生成依赖于上游凝血级联反应的充分活化 —— 活化凝血因子 FVIIIa 与 FIXa 形成复合物,激活凝血因子 X(FX)。因此,无论 FVIII 或 FIX 缺乏,都会阻碍 FX 的有效激活,导致凝血酶生成不足,进而引发凝血功能受损和自发性或创伤后过度出血[2]。
凝血因子替代疗法(通过输注外源性凝血因子FVIII 或 FIX)是当前血友病的标准治疗,将患者血浆中的浓度提升至有效止血或预防出血的水平。然而,部分患者会对此产生中和性同种抗体(alloantibody)(即抑制物,inhibitor),导致出血风险增加。因此,开发针对伴抑制物患者的更优效替代疗法一直是亟待满足的临床需求[3]。
当前,预防性非凝血因子疗法已成为另一类重要的替代治疗策略,如抗凝血酶的抑制剂等。这类疗法常采用皮下给药,相较于传统凝血因子具有更长的半衰期和更低的给药频率,可减轻治疗负担,提升了长期预防用药的可行性。Fitusiran 正是通过干扰抗凝血途径,特异性靶向抗凝血酶 AT3 mRNA,抑制抗凝血酶(AT)生成及其对凝血酶、FXa 的中和作用,促进凝血酶生成,有效预防出血(图3)[3]。
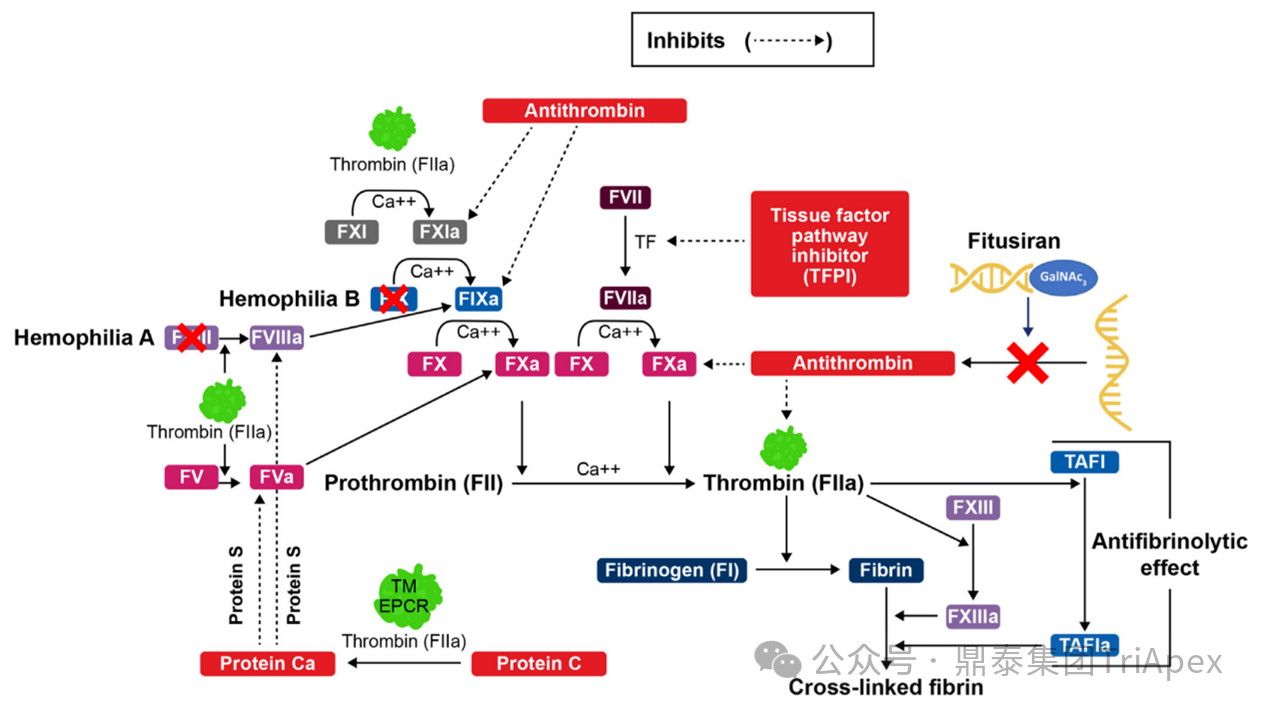
图 3. 凝血酶与抗凝血酶在止血中的作用,以及Fitusiran 的作用机制[3]
1.2、产品信息
Fitusiran 已于2025年3月28日获得美国 FDA 批准,用于 12 周岁及以上 A 型或 B 型血友病患者的日常预防治疗及出血管理,无论患者体内是否已存在 FVIII 或 FIX 抑制物。其原料药为钠盐形式的 siRNA,正义链与反义链分别含有 21 和 23 个核苷酸。siRNA 与 三个 GalNAc 基团相连,总分子量为 17193 Da。

图 4. Fitusiran 产品基本信息
由于 AT 活性过高可能增加出血风险,过低则可能导致血栓,启动 Fitusiran 治疗前,须检测患者基础 AT 活性,仅当活性大于 60% 时,才能进行给药 —— 起始剂量为 50 mg,每 2 个月皮下注射一次。治疗期间需根据 AT 活性(目标范围:15% - 35%)进行剂量和/或给药间隔调整。AT 活性应在首次给药后第 4 周、第 12 周、第 20 周、第 24 周以及任何剂量调整后进行检测:
1) AT 活性<15%:若在任一监测时点发现 AT 活性低于 15%,则需下调剂量,新剂量应在前个剂量给药 3 个月后启用;
2) AT 活性>15%:若在治疗满 6 个月后 AT 活性仍高于 35%,或患者出血控制效果不佳,应考虑上调剂量或缩短给药间隔。
除上述监测要求外,FDA 也在说明书中对 Fitusiran 给出了两项黑框警告,存在引发血栓事件以及急慢性胆囊疾病的风险,与前期临床试验的观察结果保持一致,详见下文讨论[4]。
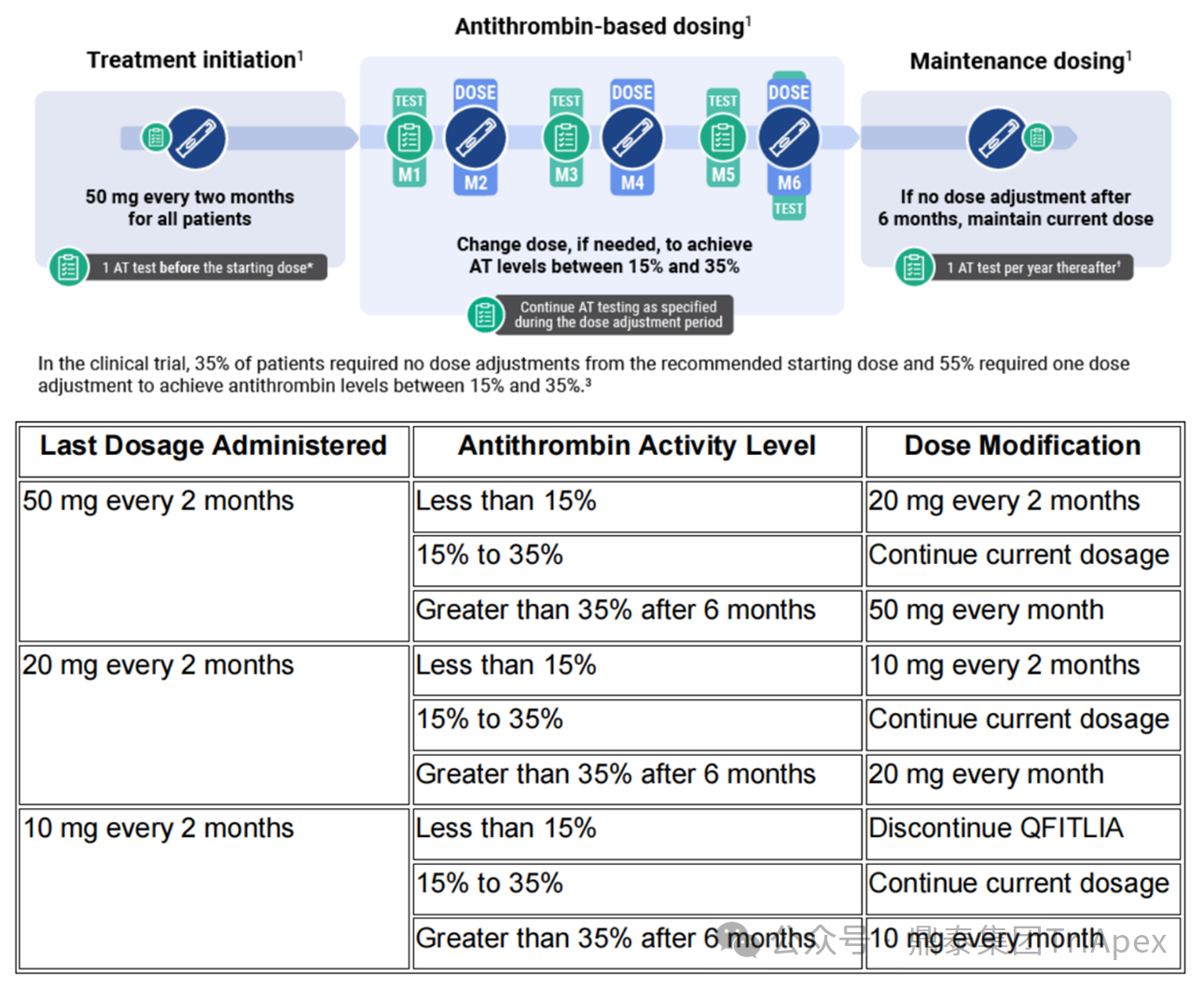
图 5. Fitusiran 临床用法用量[4]
1.3、关键监管里程碑
2013年8月16日,获得 FDA 孤儿药认证,适应症为A型及B型血友病;
2014年1月20日,在美国、英国、瑞士等多国启动首个 I 期临床试验,评估药物的安全性、耐受性及药代动力学(NCT02035605)
2018年2月起,基于早期积极数据,陆续在全球范围开展多项关键 III 期临床试验(ATLAS-INH、ATLAS-A/B、ATLAS-PPX、ATLAS-OLE)
2024年3月28日,由 Genzyme Corp 提交 NDA,寻求批准用于 A 型和/或 B 型血友病患者的预防治疗
2025年3月28日,获得 FDA 上市批准
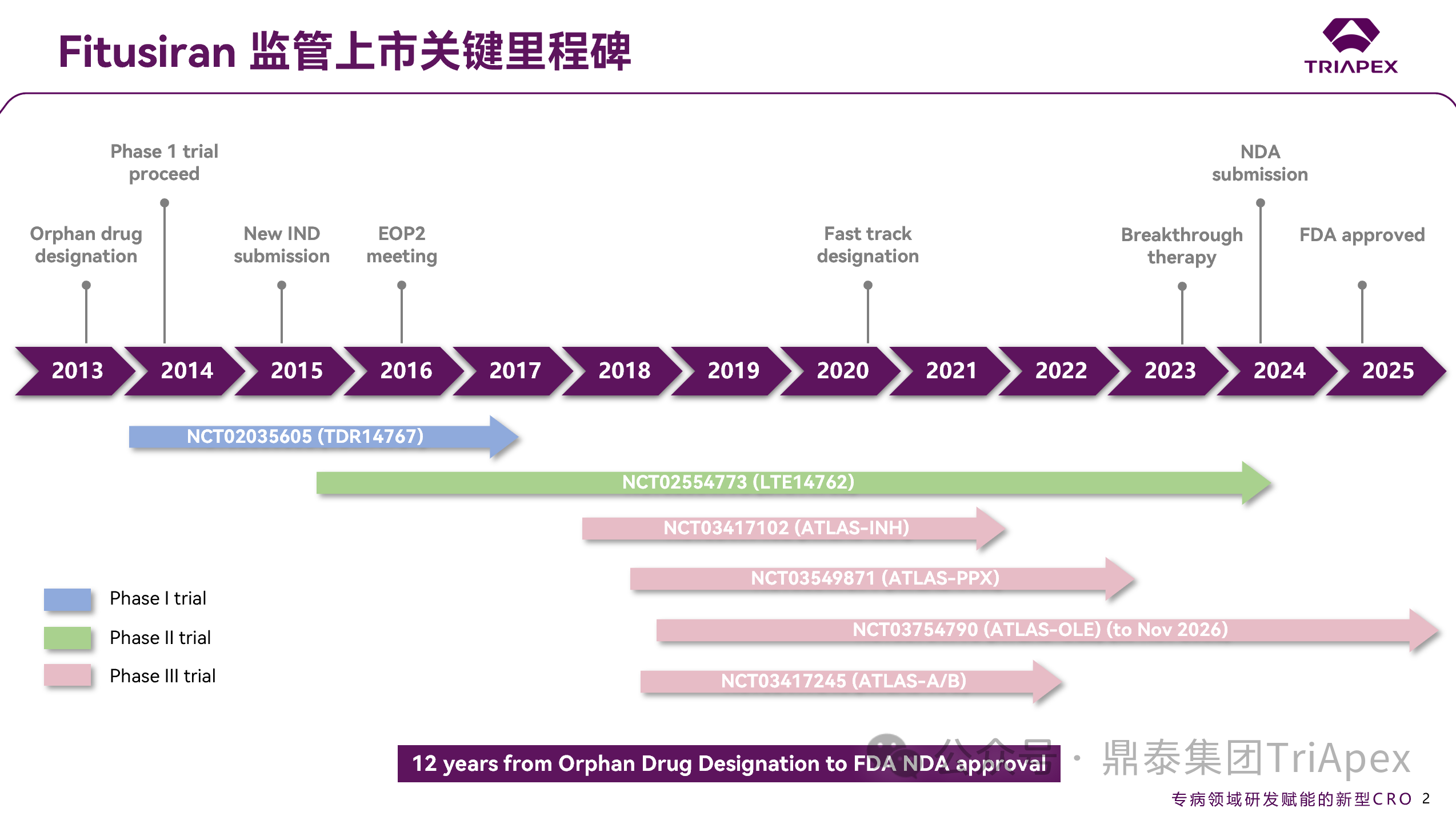
图 6. Fitusiran 监管上市关键里程碑
Fitusiran 临床开发路径
从获得 FDA 孤儿药认证到最终获批,Fitusiran 的上市之路历时 12 年之久,成为 Alnylam 管线中最为曲折的马拉松式攻坚。
其临床开发两度受阻于血栓风险安全性事件:2017年,一例参与I/II期临床(NCT02554773)的患者突发致命性脑静脉窦血栓,导致 FDA 紧急叫停全球临床试验;尽管申请人通过修订“出血管理指南”短暂重启试验,2020年10月30日,基于后续的血栓事件,申请人主动暂停了 5 个进行中的临床试验,引入基于抗凝血酶活性的给药的策略(AT-based dosing regimen,AT-DR)。这段与安全性博弈的荆棘之路,重塑了 Fitusiran 的临床开发轨迹,彰显了剂量优化的探索精神,也为后续分期试验的设计埋下了伏笔。
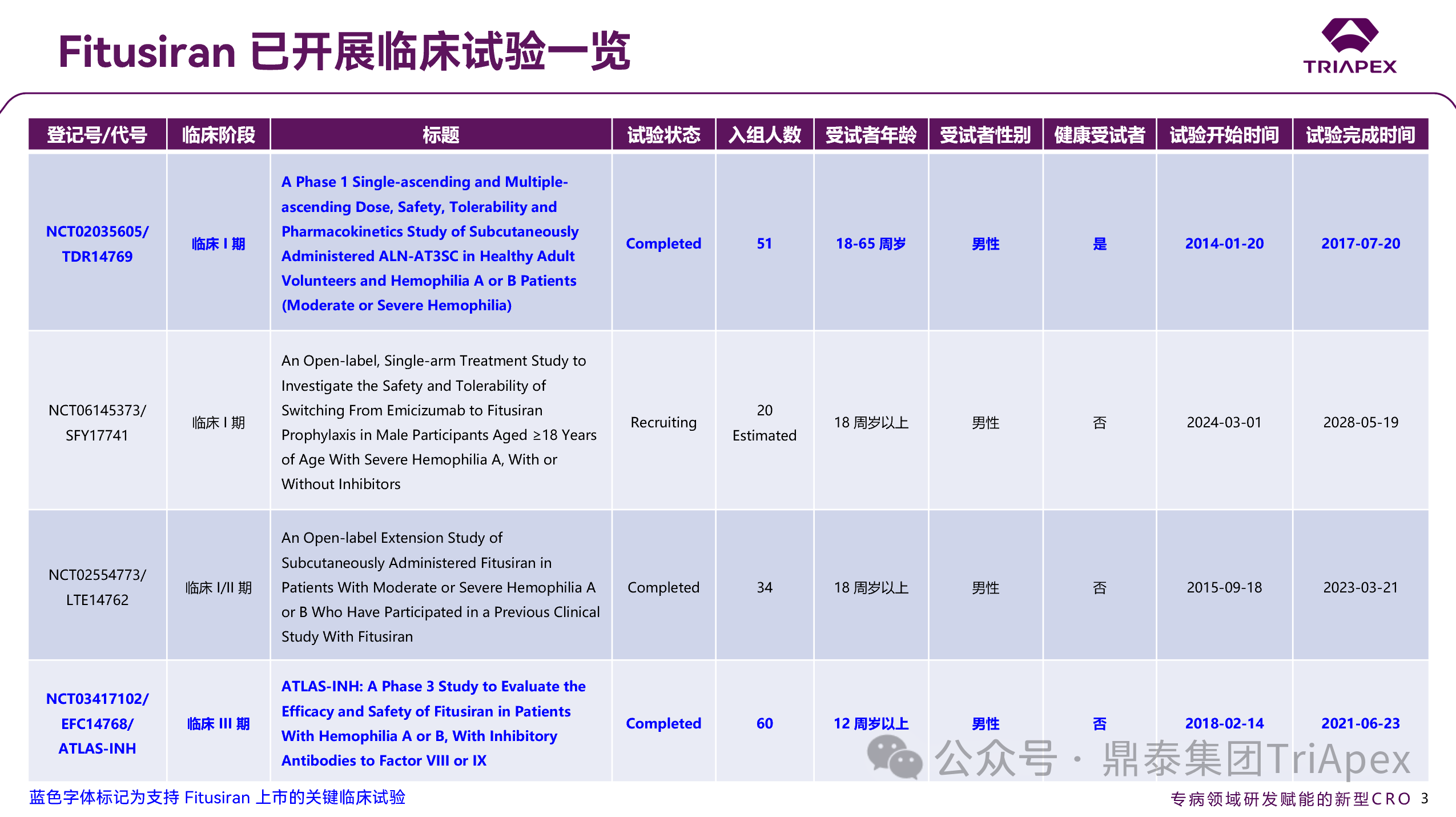
图 7. Fitusiran 已开展临床试验一览
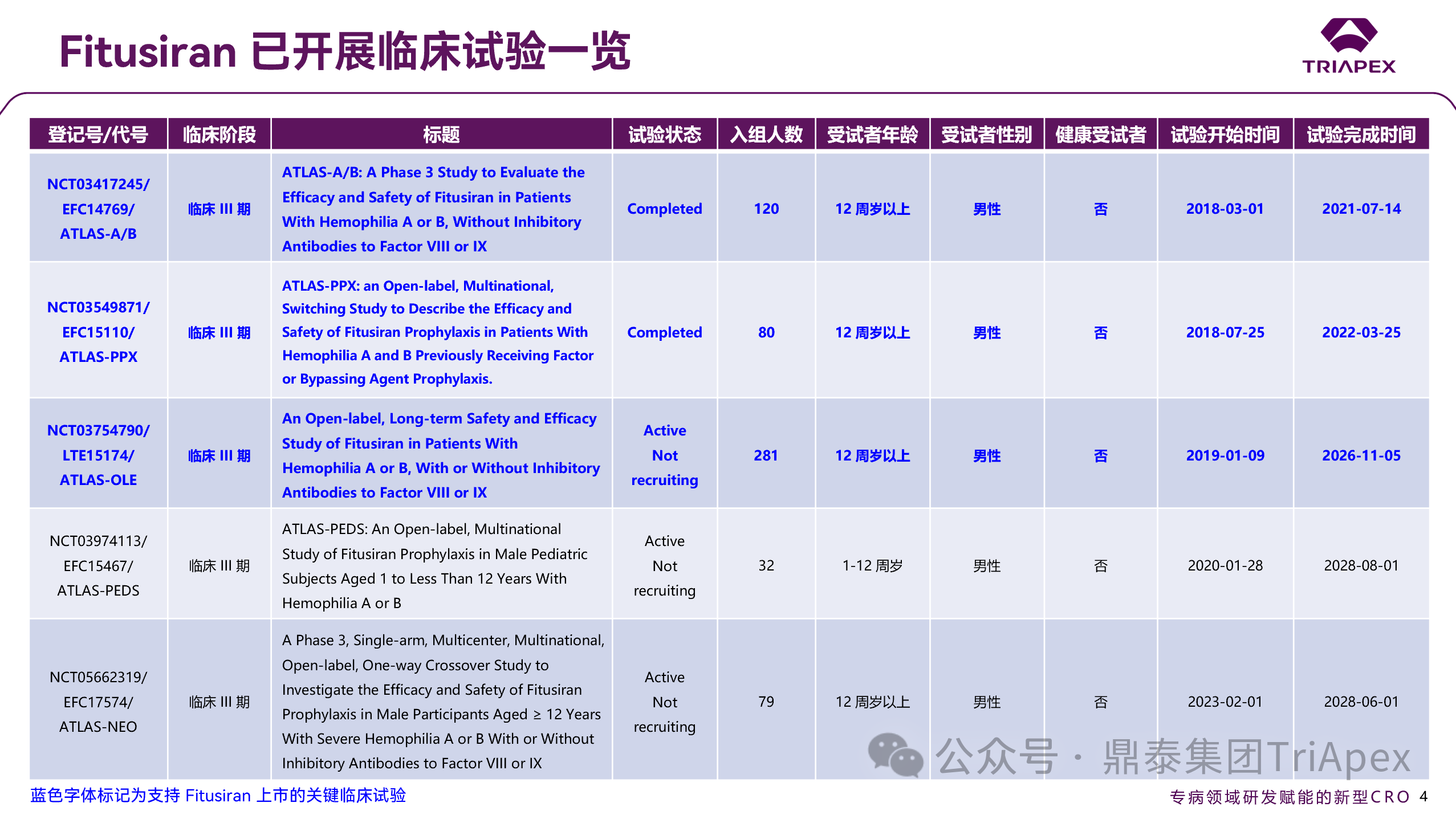
图 8. Fitusiran 已开展临床试验一览(续)
截至目前,Fitusiran 共开展 9 项临床试验,支持本次上市的关键临床试验分别为:
◆ TDR14769
I期临床,评估 Fitusiran 在人体内的安全性、耐受性;
◆ ATLAS-INH
III 期临床临床,评估 Fitusiran 在伴抑制物的血友病患者中的疗效与安全性;
◆ ATLAS-A/B
III 期临床临床,评估 Fitusiran 在不伴抑制物的血友病患者中的疗效与安全性;
◆ ATLAS-PPX
III 期临床临床,评估 Fitusiran 与传统出血预防治疗方案的疗效与安全性;
◆ ATLAS-OLE
III 期临床临床,评估基于抗凝血酶的给药方案(AT-DR)的安全性与疗效。
2.1 I期临床(TDR14769,NCT02035605)[5][6][7]
这是一项在健康成人志愿者以及中度/重度 A 或 B 型血友病患者中开展的单盲、多中心、安慰剂对照I期临床试验:
主要目的:评估 Fitusiran 在健康成年男性受试者,以及在中重度 A 型或 B 型血友病男性患者中的安全性与耐受性。
次要目的:(1)分析 Fitusiran 在受试者中的药代动力学(PK)特征;(2)评估 Fitusiran 对 AT 蛋白血浆浓度(仅 SAD 阶段)、AT 活性及凝血酶生成的药效学影响。
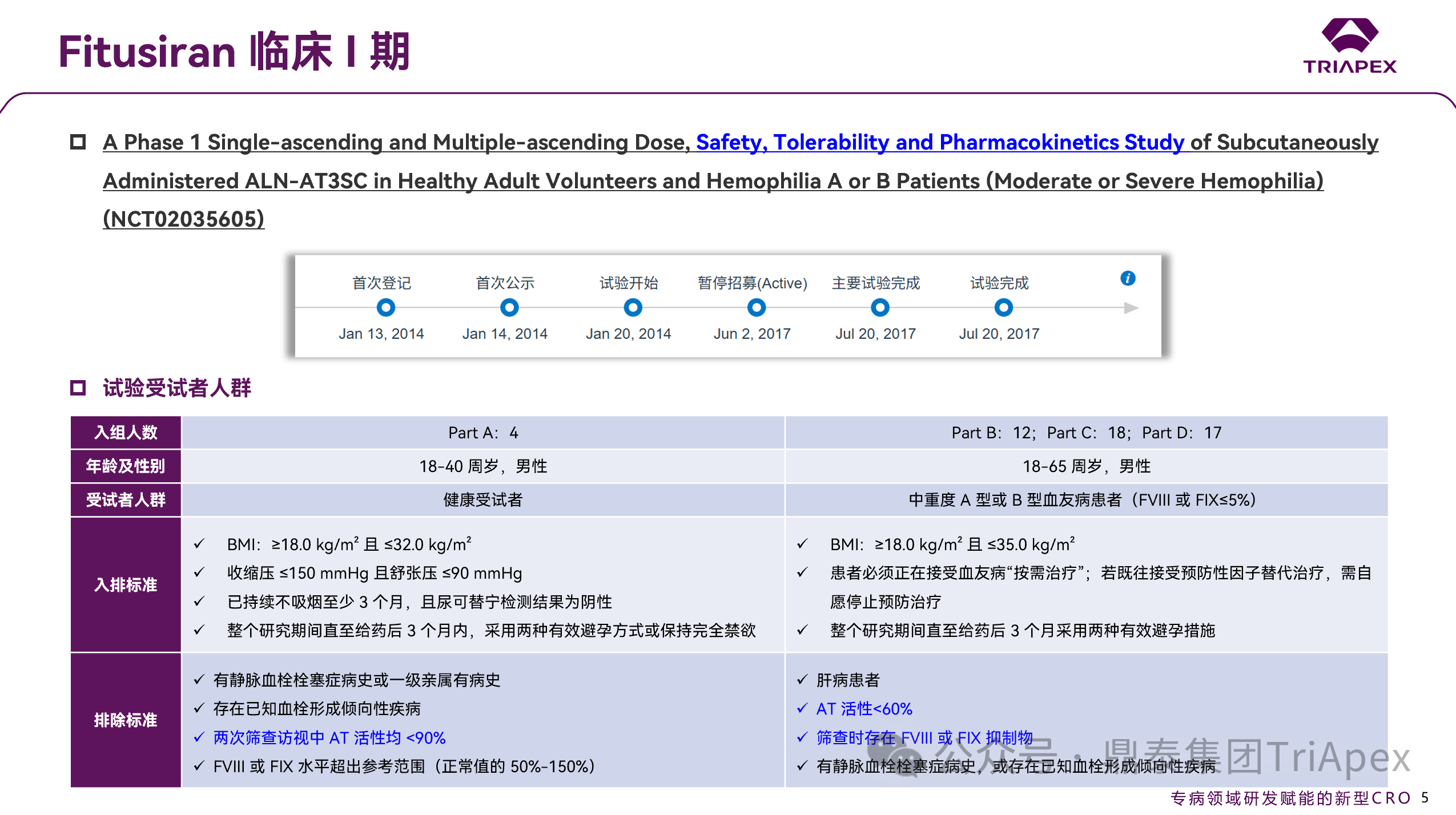
图 9. I 期临床(NCT02035605)受试者筛选标准
2.1.1 研究设计
◆ Part 1:单次递增给药(SAD)
受试者人群:健康志愿者(n=4)
给药剂量:0.03 mg/kg
原计划剂量递增方案为 0.03、0.10、0.30、0.60 和 1 mg/kg。受限于方案要求(即健康志愿者抗凝血酶活性需维持在基线水平的 ≥60%,或下降幅度≤40%),实际上仅完成了首个剂量组(0.03 mg/kg)的试验,未继续给予更高剂量。为评估 Fitusiran 在预期较低 AT 抑制水平下的药效学/药代动力学特征能否从动物模型外推至人体,在 SAD 阶段选择了较低给药剂量。
◆ Part 2:多次递增给药(MAD)
受试者人群:中重度 A 型或 B 型血友病患者(n=12)
给药剂量:0.015、0.045、0.075 mg/kg(3个队列),QW*3
根据 SAD 阶段的安全性与有效性数据,MAD 阶段的起始剂量未超过 SAD 阶段中已验证安全耐受的最高剂量水平。
◆ Part 3:MAD 探索性试验
受试者人群:中重度 A 型或 B 型血友病患者(n=16)
给药剂量:0.225、0.45、0.9、1.8 mg/kg(4 个队列),QW*3
固定剂量 80 mg(1个队列),QM*3
单次及每周给药数据显示,Fitusiran 能够显著降低 AT 的药效学作用,支持延长给药间隔(>每周一次),从而促使探索使用固定剂量每月一次重复给药的可行性。
◆ Part 4:MD
受试者人群:中重度 A 型或 B 型血友病患者(n=17)
给药剂量:固定剂量 50、80 mg,QM*3,MD 阶段患者可以在 MAD 阶段结束前开始给药,同一 MD 剂量组内患者可同期给药
尽管预期 Fitusiran 的作用机制对所有血友病患者均适用(无论是否存在抑制物),但在 Part B、C 中,将存在抑制物列入排除标准。为弥补此局限,后续试验修订了研究方案,增加了 Part D,以纳入携带此抑制物的患者。
*注:Part B-D 的受试者可进入 I/II 期开放标签扩展试验。其初始剂量基于体重计算,后续将根据 I 期研究中的给药方案调整为每月固定剂量(50 mg 或 80 mg)。
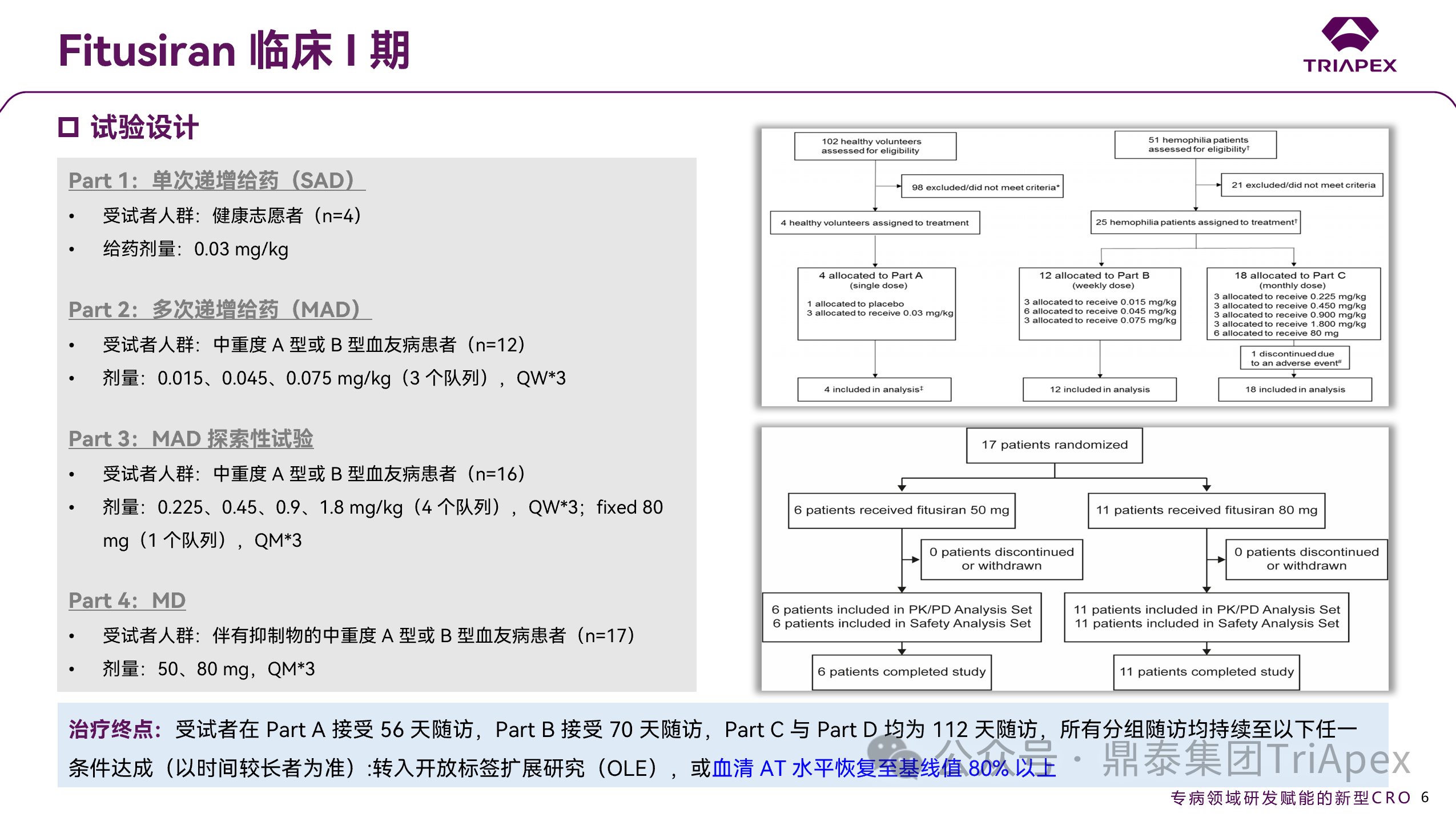
图 10. I 期临床(NCT02035605)试验设计
2.1.2 FIH 试验起始剂量设计依据
Fitusiran 的 FIH 起始剂量设计主要基于 Alnylam 自身 GalNAc-siRNA 平台在动物与人体的转化经验,选用与人体预测性最敏感的食蟹猴作为相关种属。
首先,依据 NHP 7 周重复给药毒性试验确定的 NOAEL 0.3 mg/kg,按 1:1 外推至人体,并采用 10 倍安全系数换算的人体起始剂量为 0.03 mg/kg。由于毒理试验(QW*7)和I期临床试验(仅单次)的给药次数不同,申请人认为上述换算方式是保守的。
其次,参考食蟹猴单次给药无药效学活性剂量(0.1 mg/kg)外推至人体 MABEL,认为 0.03 mg/kg 剂量仍有 3.3 倍安全窗。
最终,通过哨兵给药策略确保在 SAD 阶段仅 1 例受试者接受起始剂量给药且经安全性评估后方可进行其他受试者的给药。

图 11. FIH 试验起始剂量设计依据
2.1.3 主要试验结果
2.1.3.1 安全性数据
整个研究期间未报告药物相关的严重不良事件(SAE),也未观察到任何血栓事件。多数受试者的 D-dimer 水平相对基线保持稳定,部分受试者中的升高也未伴随其他凝血标志物异常。Part D 中,D-dimer 的升高幅度与给药剂量呈现一定的正相关性。最常见药物相关不良反应为注射部位疼痛/红斑(20/45, 44%),同时,部分受试者(14/45,31%)出现了短暂、无症状的 ALT、AST 等肝酶升高。
在 Part C 中,一例接受 80 mg 固定剂量的受试者在第 44 天出现了重度非严重的非心源性胸痛,伴随出现 C 反应蛋白、ALT、AST 及 D-dimer 水平的升高,判定可能与 Fitusiran 相关,受试者在第 45 天退出研究。后续腹部超声仅发现胆囊淤积,未见其他相关医学异常。

图 12. I 期临床(NCT02035605)安全性数据(Part A & B & C)
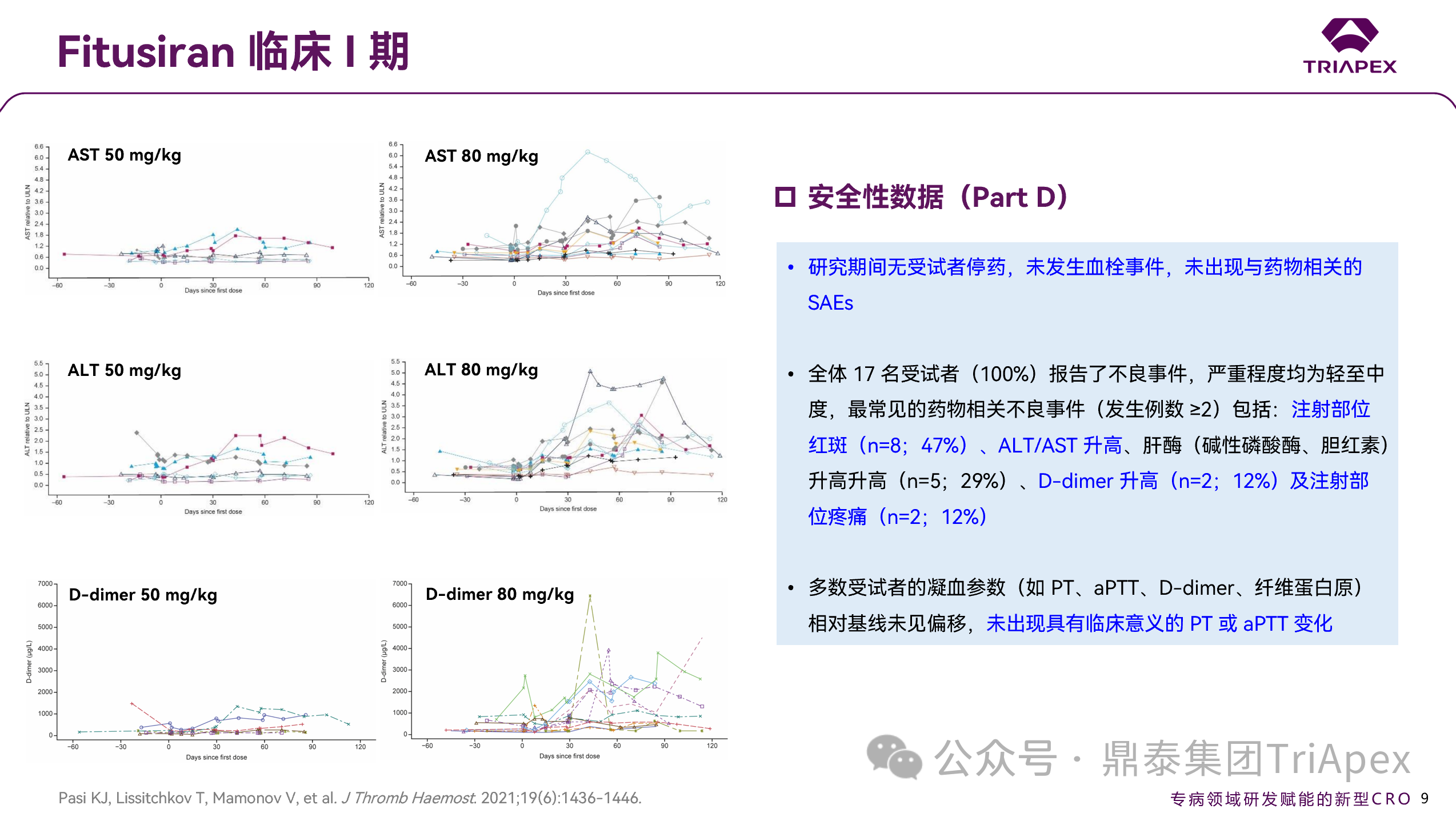
图 13. I 期临床(NCT02035605)安全性数据(Part D)
2.1.3.2 PK 数据
整个研究中, Fitusiran 血浆浓度成剂量依赖性,Tmax多出现在 2-6 h之间,平均消除半衰期为 2.6-5.3 h,且在伴/不伴抑制物的血友病患者中呈现相似的 PK 参数。
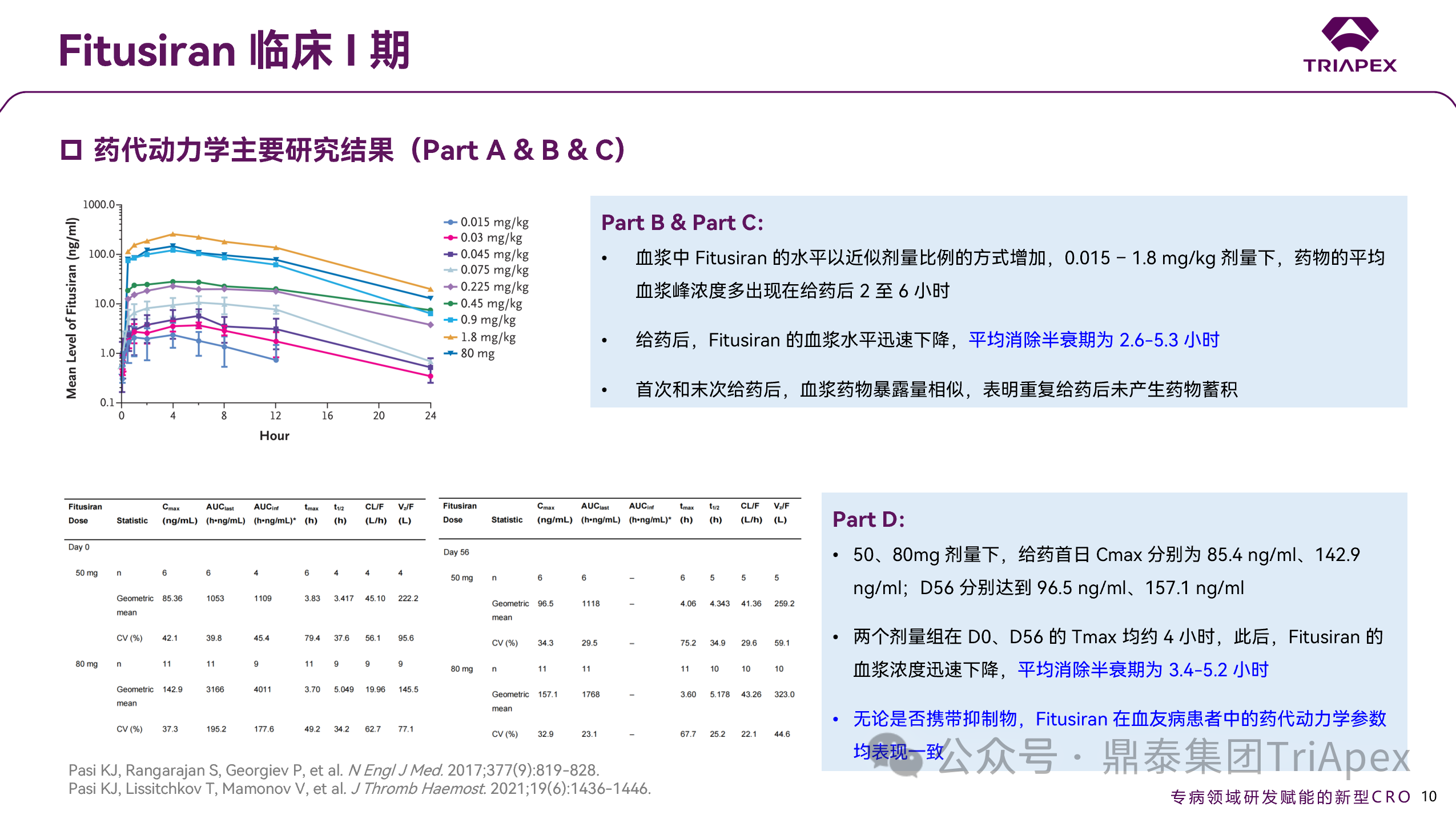
图 14. I 期临床(NCT02035605)药代动力学数据
2.1.3.3 PD 数据
健康受试者与血友病患者的基线 AT 水平相似。健康受试者 AT 降幅可达 19%;血友病患者在 QW 和 QM 给药方案下均呈剂量依赖性下降:最高周剂量 0.075 mg/kg 下最大降幅为 61%,最高月剂量 1.8 mg/kg 下最大降幅为 89%。QM 频率固定剂量 80 mg 也能稳定降低87%,因此,QM 的给药间隔,或可助于提供更恒定的止血保护,也是 Part D 选择 QM 固定给药的重要原因之一。
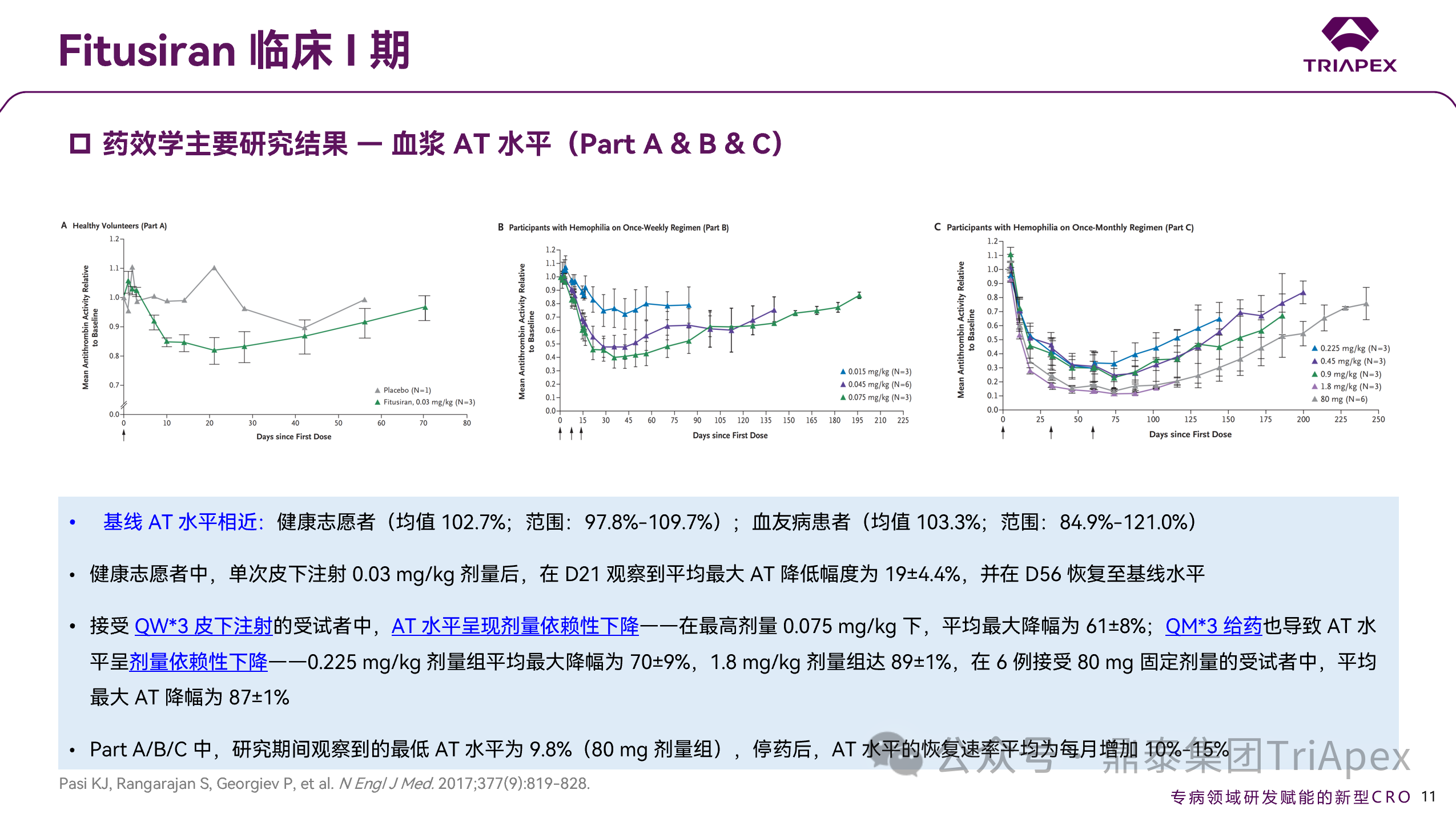
图 15. I 期临床(NCT02035605)药效学数据(Part A & B & C)
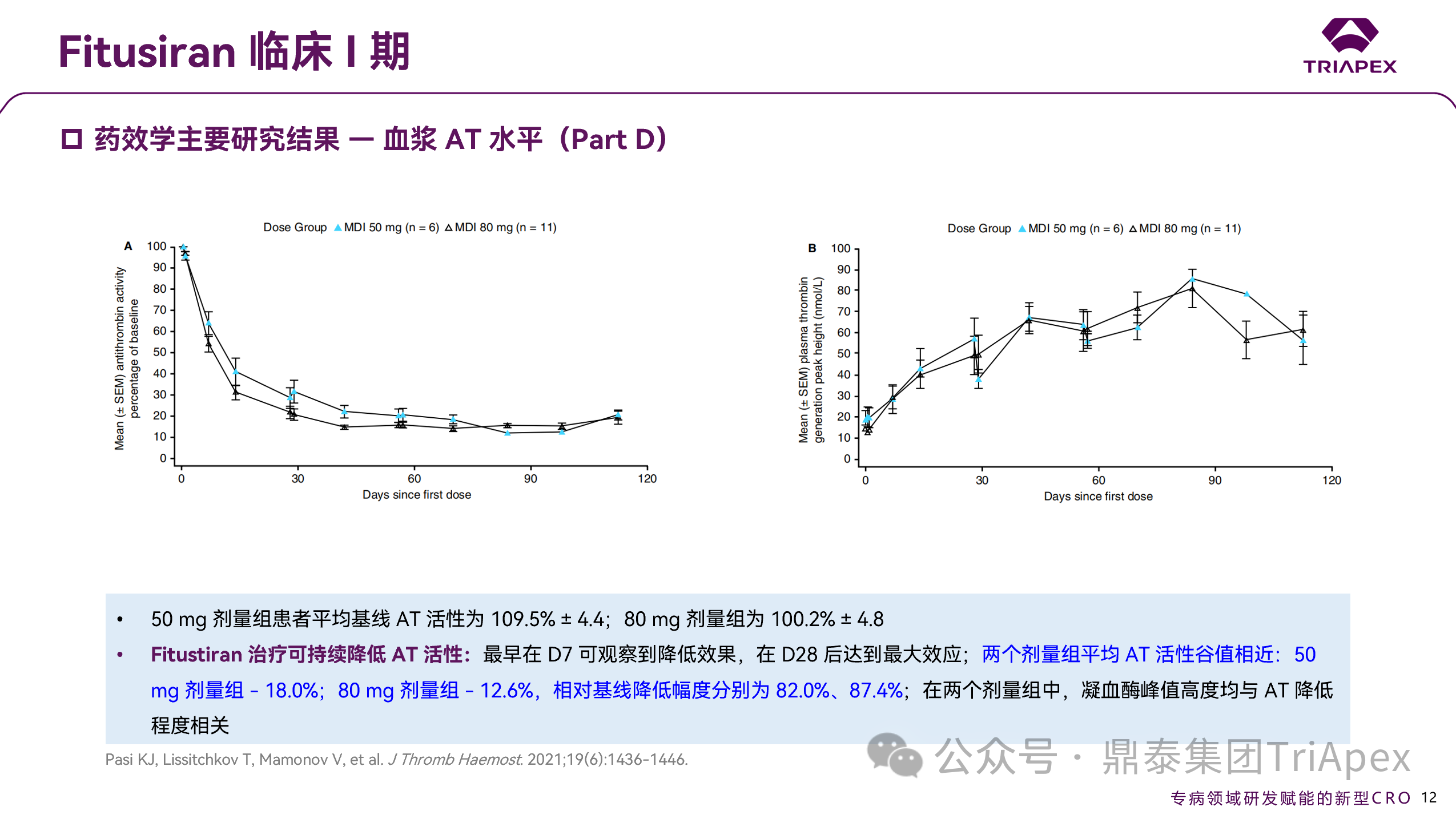
图 16. I 期临床(NCT02035605)药效学数据(Part D)
2.2 III 期临床(ATLAS-INH,NCT03417102)[8][9]
ATLAS-INH 是一项多中心、跨国、随机、开放标签的III期研究,旨在评估 Fitusiran 在≥12 岁伴 FVIII 或 FIX 抑制物的男性 A 型或 B 型血友病患者中的疗效与安全性(入组前未接受预防性治疗)。本研究首次将年龄下限扩展至 12 岁,依据在于:12-18 岁青少年患者的疾病进展特征、出血事件管理模式与成人一致,且血友病自我管理普遍从 12 岁开始[10]。符合入排标准的受试者(n=60)按 2:1 的比例随机分配至:
Fitusiran 治疗组(n=41):接受 80 mg 每月一次皮下注射给药作为预防性治疗,同时按需使用旁路制剂(BPA)治疗突破性出血事件;
按需治疗组(n=19):仅按需使用 BPA 治疗突破性出血事件
治疗时长为 9 个月,试验主要目的在于通过出血事件发生频率评估 Fitusiran 相较于按需使用 BPA 的疗效,主要终点为疗效评估期的年化出血率(ABR)。

图 17. III 期临床(NCT03417102)受试者筛选标准及试验目的

图 18. III 期临床(NCT03417102)试验设计
III 期临床剂量设置依据
选择每月固定剂量 80mg 的核心依据源于已完成/进行中的临床研究数据、建模模拟及关键 PD 参数验证。基于 I 期和 I/II 期研究在月等效剂量和月固定剂量的观察:
剂量与 AT 抑制呈正相关,在 90% 降低水平时达平台,更高剂量无法实现具有临床意义的额外抑制
50mg 与 80mg 均能使凝血酶峰值达正常范围下限
根据建模结果,预测固定剂量 80mg 可接近最大化降低 ABR,并达到 ≥75% AT 抑制目标
体重协变量分析表明,按体重给药无优势
综上,结合 I/II 期临床数据,每月固定剂量80mg方案具备最佳风险获益潜力。
2.2.1 主要试验结果
2.2.1.1 主要疗效终点结果
Fitusiran 组 ABR 中位数为 0.0(范围:0.0-1.7),显著低于 BPA 组的 16.8(范围:6.7-23.5);组间均值对比显示,Fitusiran(1.7)较 BPA 组(18.1)实现 90.8% 相对出血率降幅。治疗期间,Fitusiran 组 25 例受试者无出血事件,BPA 组仅 1 例实现零出血。
2.2.1.2 安全性数据
Fitusiran 组共 38 例受试者(93%)报告 ≥1项治疗期 AE,最常见 AE 包括 ALT 升高(32%)、AST 升高(20%)及上呼吸道感染(15%)。
Fitusiran 组治疗期间出现的药物相关特别关注不良事件(TEAESI)
肝脏安全性(转氨酶升高>3 倍正常值上限ULN)—— 共 10 例(24%),事件多发生于用药 60 天内,均为非严重性轻中度不良反应(中位恢复时间:42 天);
血栓事件 —— 共报告 2 例(5%),其中 1 例脊髓血管病变伴血栓形成被判定与 Fitusiran 相关,最终导致治疗终止,BPA 组无相关事件报告;
胆囊疾病 —— 共报告 6 例(15%)胆囊炎/胆石症,BPA 组无相关事件报告。
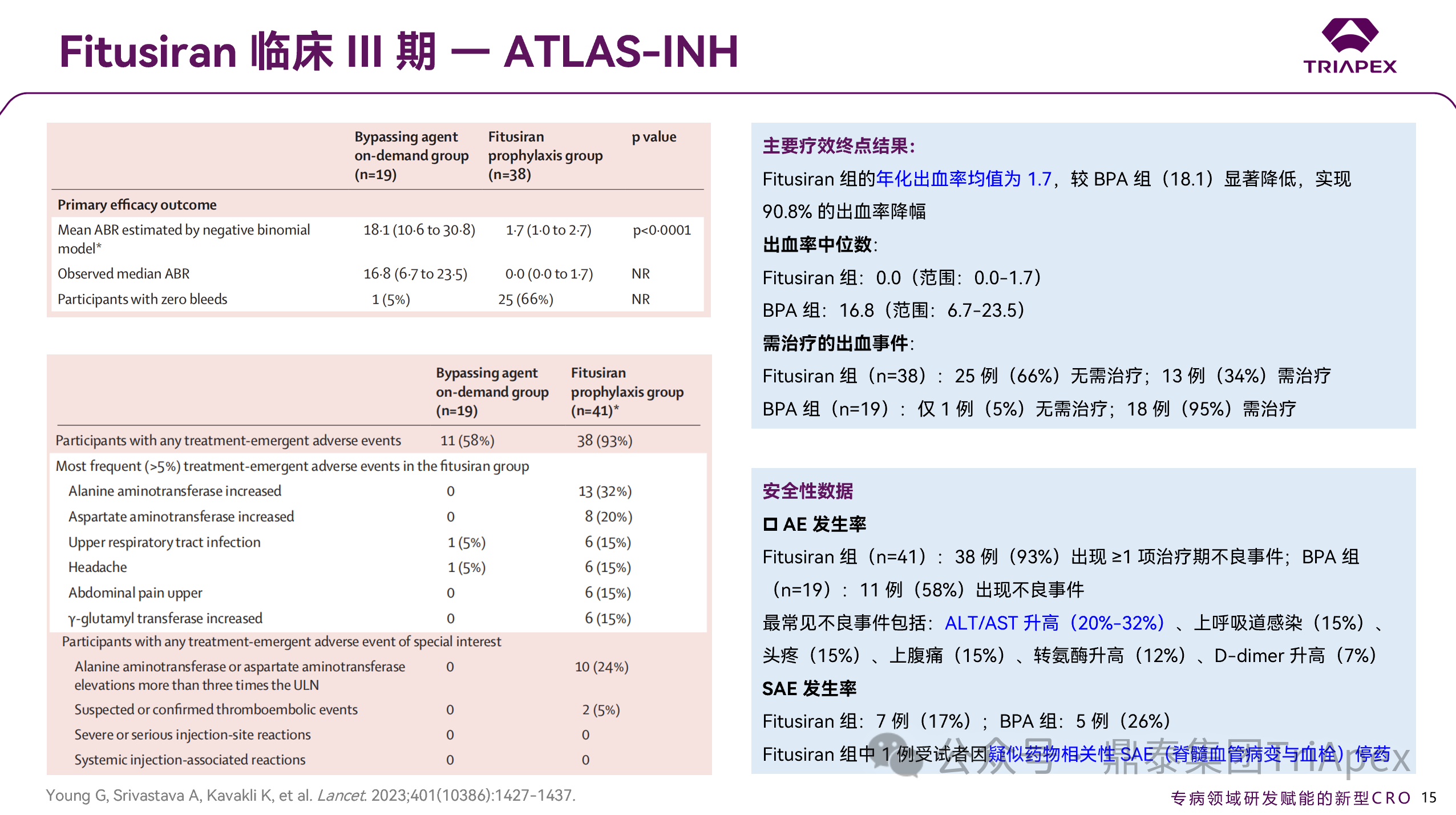
图 19. III 期临床(NCT03417102)疗效及安全性数据
2.2.1.3 PD 结果
采用 Fitusiran 80 mg QM 的给药方案可持续抑制 AT 活性 —— 起效期末,AT 活性较基线下降 84%;疗效评估期至研究结束,AT 活性仍维持高抑制水平(84-90%)。同时,凝血酶峰值在治疗期间持续升高,较基线上升达 540%,并能稳定维持。
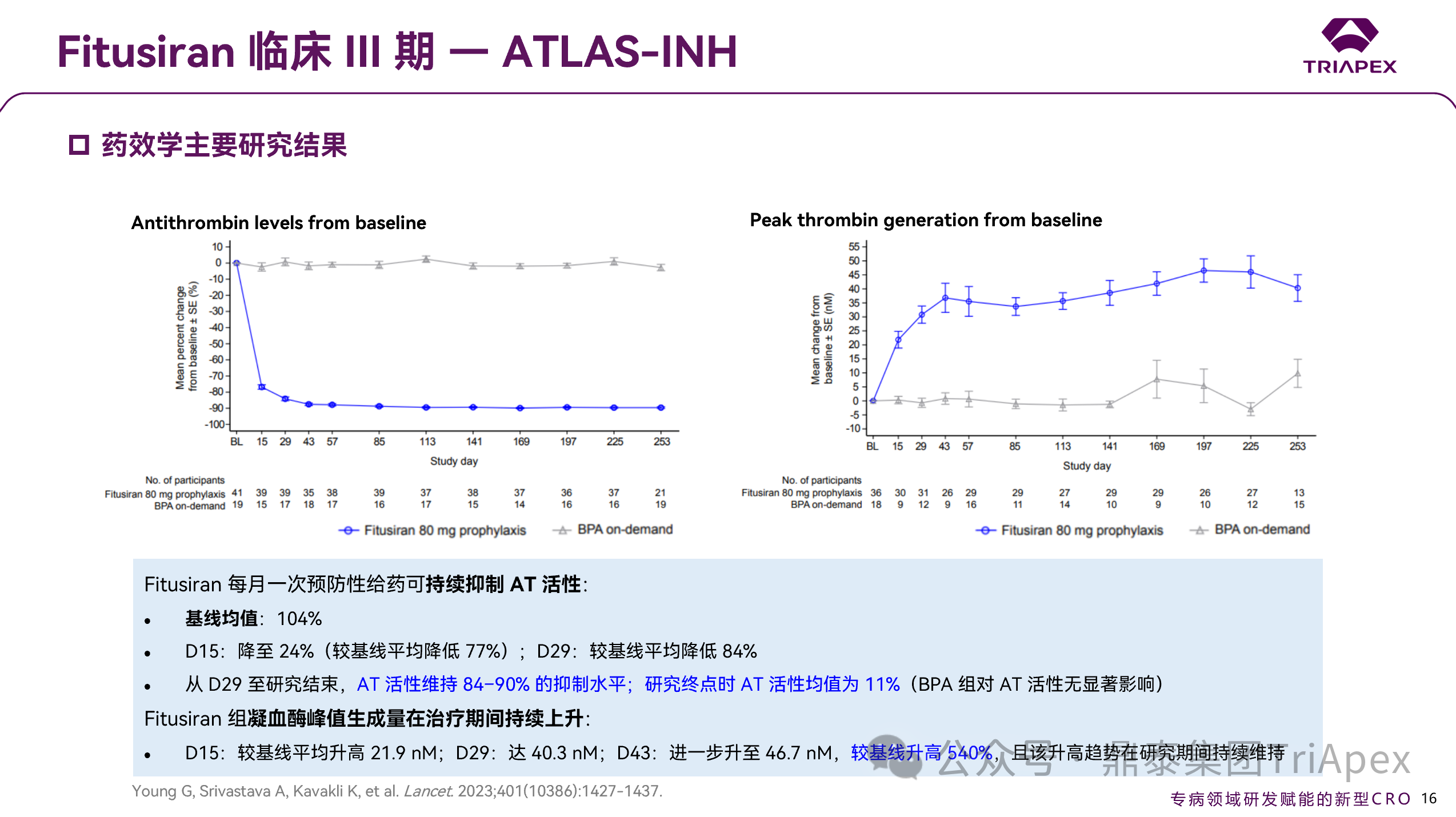
图 20. III 期临床(NCT03417102)药效学数据
2.3 III 期临床(ATLAS-A/B,NCT03417245)[11][12]
ATLAS-A/B 旨在评估 Fitusiran 在 ≥12 岁不伴 FVIII 或 FIX 抑制物的男性 A 型或 B 型血友病患者中的疗效与安全性(入组前未接受预防性治疗)。与 ALTAS-INH 设计相似,符合入排标准的受试者(n=120)按 2:1 的比例随机分配至:
Fitusiran 治疗组(n=80):接受 80 mg 每月一次皮下注射给药,同时按需使用 BPA 治疗突破性出血事件;
按需治疗组(n=40):仅按需使用凝血因子浓缩剂(CFC)治疗突破性出血事件
治疗时长为 9 个月,试验主要目的在于通过出血事件发生频率评估 Fitusiran 相较于按需使用 CFC 的疗效,主要终点为疗效评估期的 ABR。

图 21. III 期临床(NCT03417245)受试者筛选标准及试验目的
2.3.1 主要试验结果
2.3.1.1 主要疗效终点结果
Fitusiran 组 ABR 中位数为 0.0(范围:0.0-3.4),显著低于 CFC 组的 21.8(范围:8.4-41.0)。治疗期间,Fitusiran 组 40 例(51%)受试者实现零治疗出血事件,而 CFC 组仅 2 例(4%),比例相对提升约 90%。与 ATLAS-INH(伴抑制物患者)试验结果相同 —— Fitusiran 组中位 ABR 均为 0。两项 III 期试验共同证实无论是否伴抑制物,Fitusiran 均可作为 A 型或 B 型血友病的有效预防方案。
2.3.1.2 安全性结果
Fitusiran 组治疗期 AE 发生率为79%(62/79),常见AE包括:ALT 升高(23%)、上呼吸道感染(11%)及 AST 升高(8%)。此外,共报告 5 例 SAE(6%),包括胆石症(2例)及胆囊炎(1例)。
Fitusiran 组治疗期间出现的 TEAESI
肝脏安全性(转氨酶>3 倍 ULN)—— 共15例(19%),均为非严重性轻中度不良事件,其中 5 例暂停或终止给药,中位恢复时间为 57 天(范围:15-243天);CFC 组仅报告1例;
血栓事件 —— 未报告任何血栓事件;
胆囊疾病 —— 共报告 5 例(6%)胆囊炎/胆石症,CFC 组无胆囊事件报告
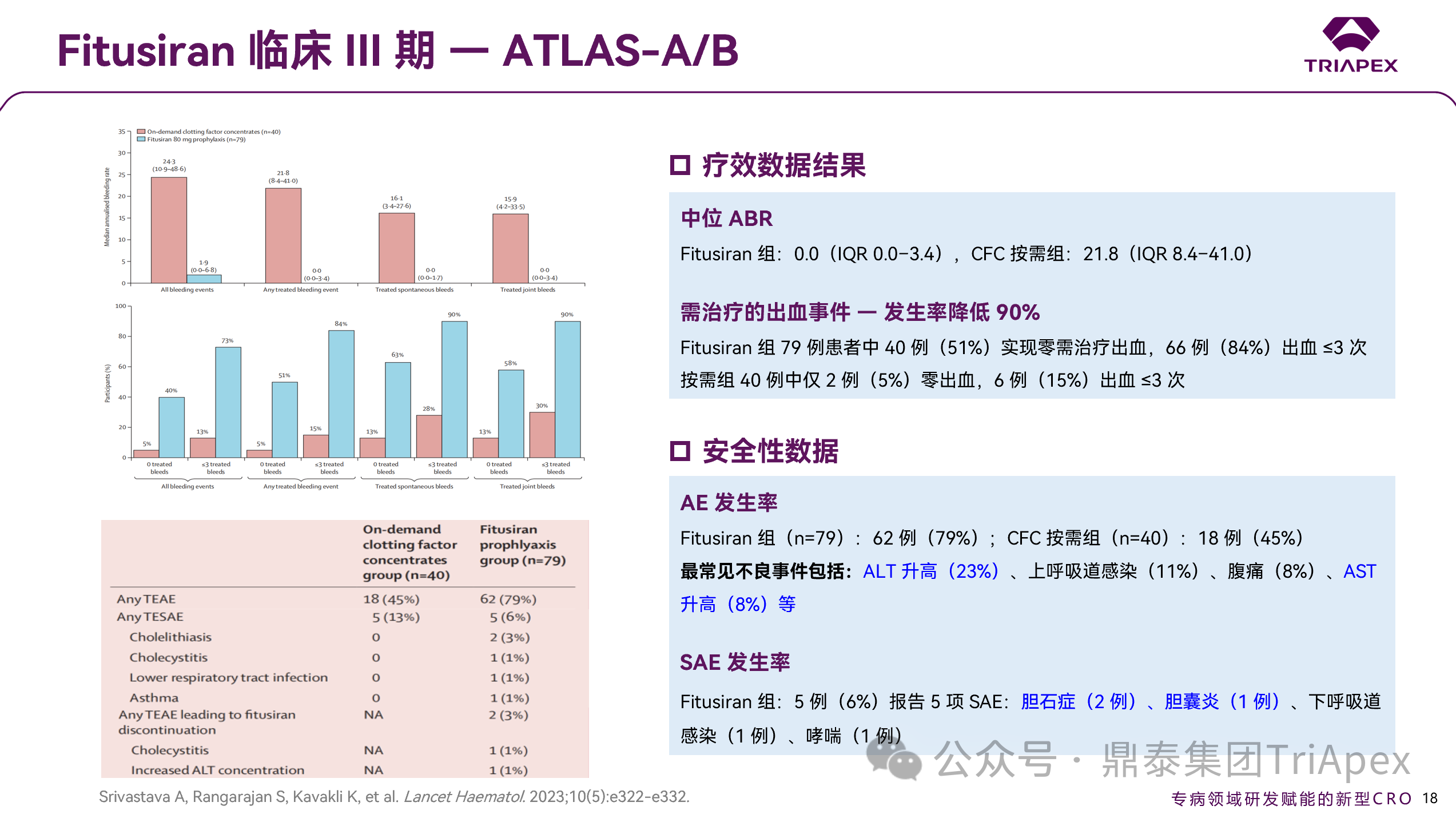
图 22. III 期临床(NCT03417245)疗效及安全性数据
2.3.1.3 PD 结果
疗效评估期至研究结束,AT 活性稳定维持在 12%-14%,凝血酶峰值较基线稳定升高 29.8-43.1 nmol/L。
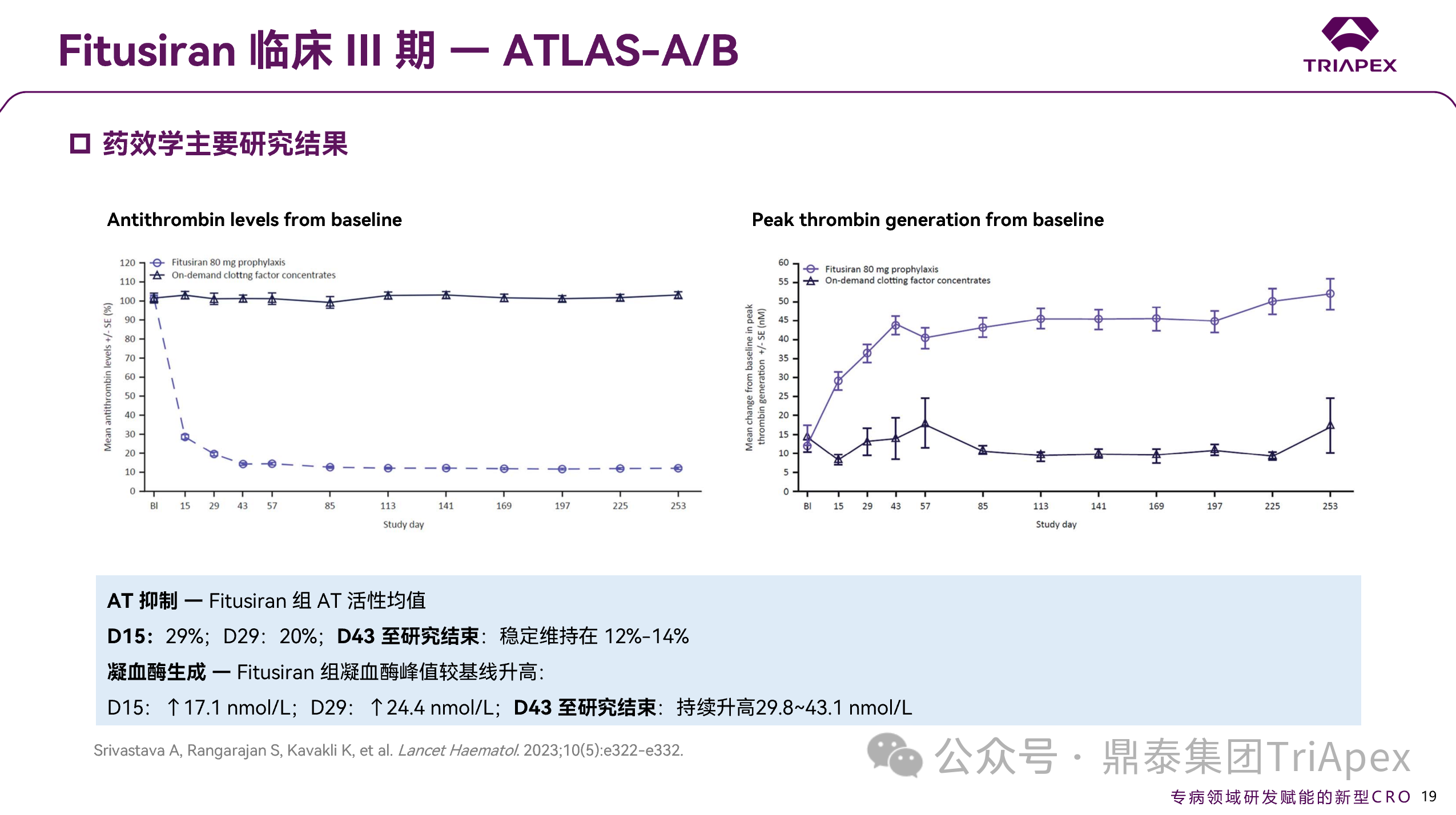
图 23. NCT03417245 III 期临床药效学结果
2.4 III 期临床(ATLAS-PPX,NCT03549871)[13][14]
ATLAS-PPX 旨在评估 Fitusiran 在 ≥12 岁接受过 BPA 或 CFC 预防治疗的 A 型或 B 型血友病男性患者中的疗效和安全性。符合入排标准的受试者(n=80)将被分为 2 个队列:
队列 A(n=30):既往对 FVIII 或 FIX 产生抑制物的患者。启动 Fitusiran 治疗前需完成 6 个月的常规 BPA 或 CFC 治疗。其中包含 1 个亚组(n=2)—— 存在抗 FIX 抑制物且对 BPA 预防治疗反应不充分的 B 型血友病患者;
队列 B(n=50):对 FVIII 或 FIX 未产生抑制物的患者。启动 Fitusiran 治疗前同样需完成 6 个月预防期治疗。
治疗时长为 7 个月,共 64 例(80.0%)受试者完成全程研究。试验主要目的在于通过出血事件发生频率评估 Fitusiran 相较于按需使用 BPA 和 CFC 的疗效,主要终点为疗效评估期的 ABR。

图 24. NCT03549871 III 期临床受试者筛选条件及试验目的
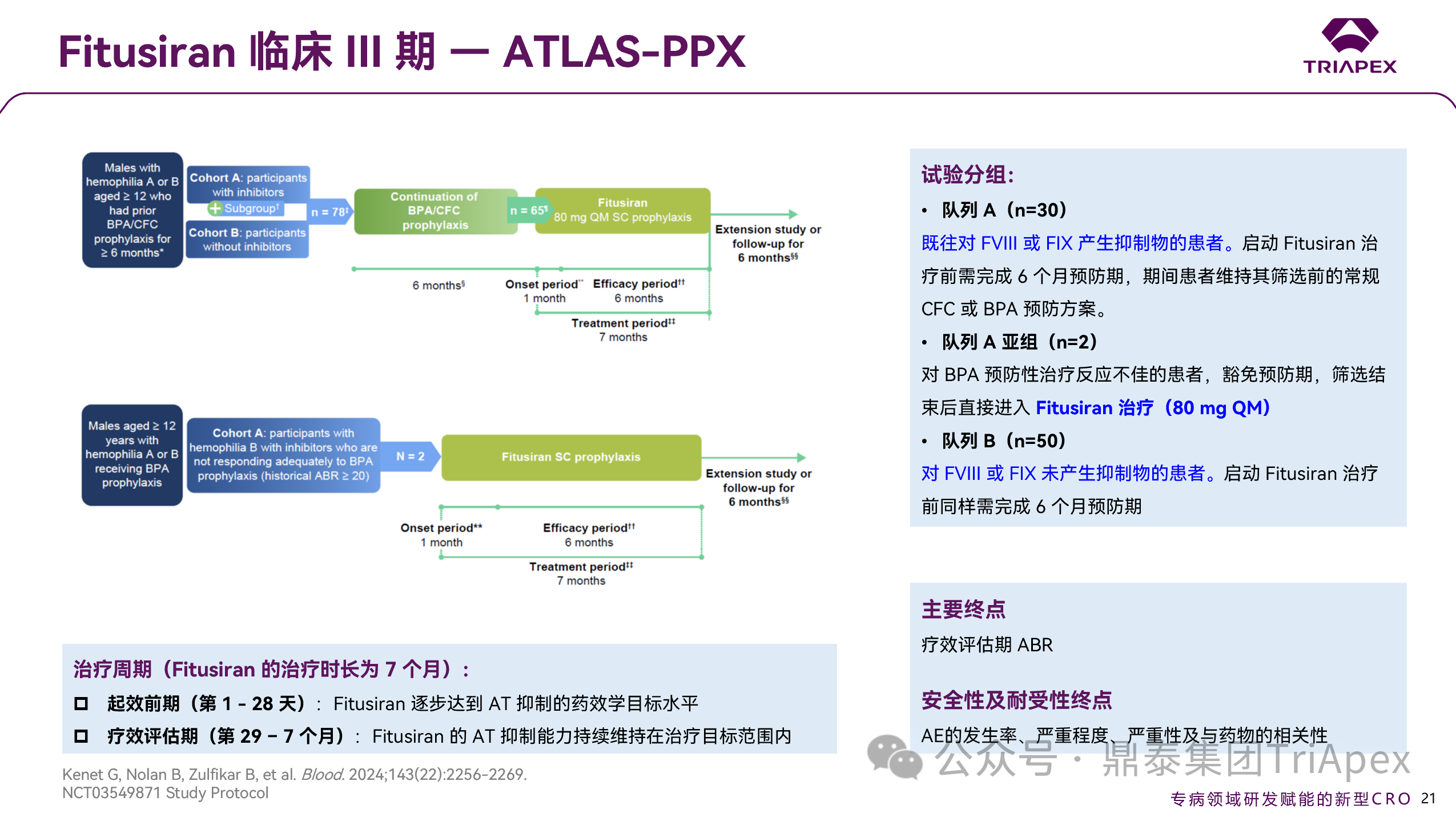
图 25. III 期临床(NCT03549871)试验设计
2.4.1 主要试验结果
2.4.1.1 主要疗效终点结果
Fitusiran 治疗组中,中位 ABR 为 0.0(范围:0.0–2.3),相较于 BPA/CFC 预防组的 4.4(范围:2.2–10.9)显著降低。建模结果显示,预估 Fitusiran 治疗可使出血率降低 61.1%。此外,无论受试者是否伴有抑制物,其中位 ABR 均为 0.0,无显著差异。
2.4.1.2 PD 数据
Fitusiran 疗效评估期内,AT 活性维持在 10.6%–13.4%,凝血酶峰值维持在 47.6–62.6 nM。无论受试者是否伴有抑制物,其 AT 活性和凝血酶生成变化趋势均保持一致。
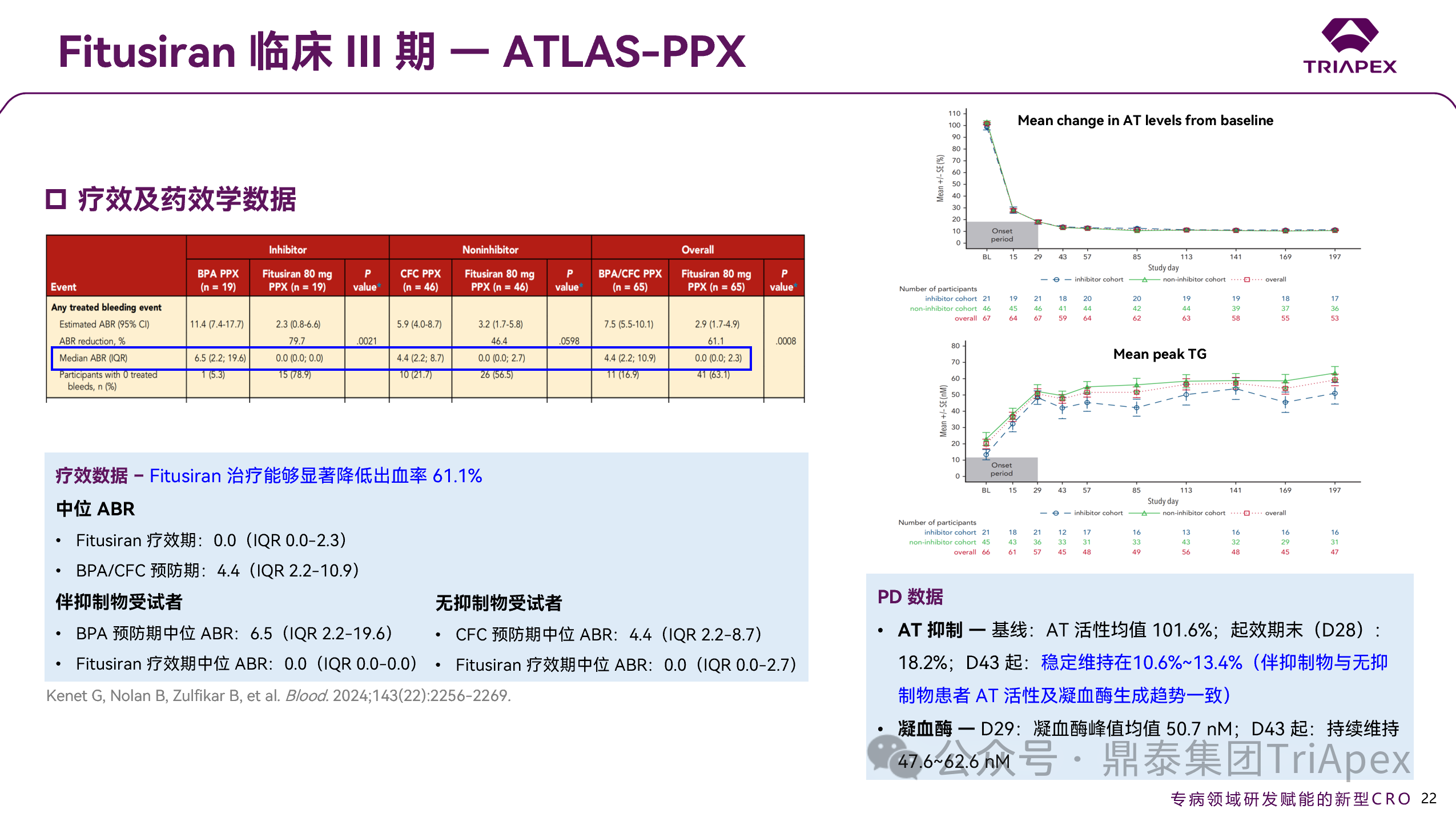
图 26. III 期临床(NCT03549871)疗效结果及药效学数据
2.4.1.3 安全性数据
Fitusiran 治疗常见 AE 包括 ALT 升高(26.9%)、上呼吸道感染(9.0%)、D-dimer 升高(7.5%)及 AST 升高(6.0%),共 9 名受试者(13.4%)报告了 13 项 SAE,其中 3 名受试者的 SAE 被判定与 Fitusiran 相关。
Fitusiran 治疗期间出现的 TEAESI
肝脏安全性(转氨酶>3 倍 ULN)——17 例(25.4%)报告平均峰值 4.8×ULN,平均持续 41.1 天,多在用药后 D90、D135 内发生,均非严重;BPA/CFC 预防期仅有 2 名患者(3.1%)报告
血栓事件 —— 共 2 名受试者(3.0%)报告与 Fitusiran 相关的血栓事件,BPA/CFC 预防期无相关报告
胆囊疾病 —— 共 8 例(胆囊炎合并胆石症 2 例,非结石性胆囊炎 3 例,胆石症 3 例,慢性胆囊炎 1 例),BPA/CFC 预防期无相关报告
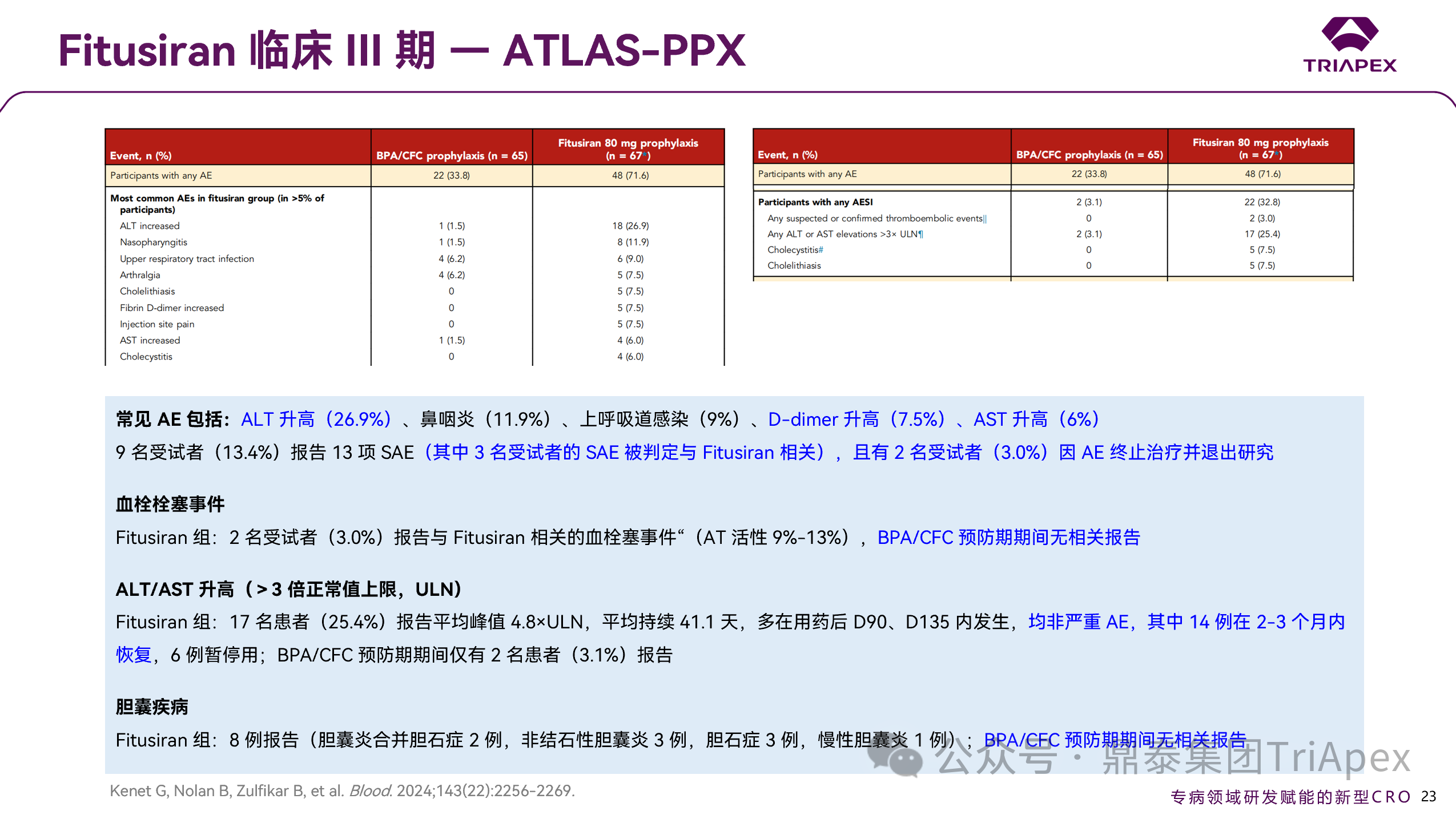
图 27. III 期临床(NCT03549871)安全性数据
2.5 III 期临床(ATLAS-OLE,NCT03754790)[15]
ATLAS-OLE 旨在评估 AT-DR 方案在≥12 岁重度 A 型或 B 型血友病男性患者(伴或不伴抑制物)中的安全性与有效性。
该研究共纳入 281 例受试者,原定在开放标签期内统一采用固定剂量 80 mg QM 方案。然正如前文所述,基于临床血栓风险发生率较高,申情人于 2020 年暂停了所有进行中的临床试验,并引入 AT-DR 个体化风险管理策略。重启后的 ATLAS-OLE 作为首个实施 AT-DR 的临床研究,受试者(包括新入组和重新入组者)进入 48–76 个月治疗期,起始剂量为 50 mg QM,后续根据 AT 活性目标(15%–35%)调整剂量:
剂量下调:若 AT 活性连续两次 <15%,立即停药并下调至 20 mg QM;
剂量上调:AT 活性至少两次 >35%,上调至 50 mg QM;在 50 mg QM 剂量下 AT 仍 >35%,且既往治疗中 AT<15% 次数 ≤1次,可上调至 80 mg QM。
试验最初的主要目的在于评估 Fitusiran 长期用药的安全性,但最终变为了评估受试者在 AT-DR 方案下的安全性和疗效。

图 28. III 期临床(NCT03754790)受试者筛选标准及试验目的、终点
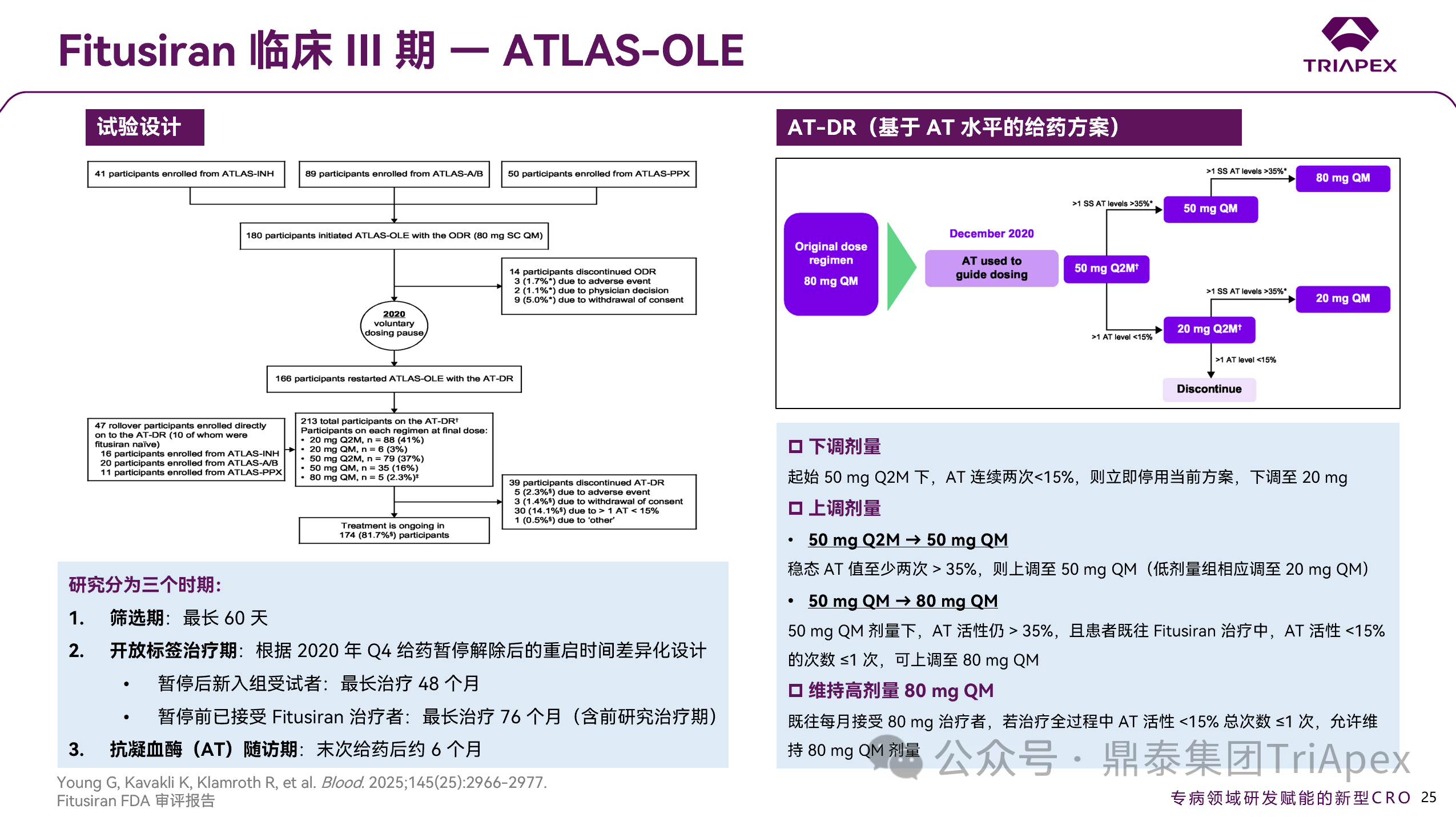
图 29. III 期临床(NCT03754790)试验设计及 AT-DR 方案
2.5.1 主要试验结果
2.5.1.1 安全性数据
共发生 238 例与治疗相关的 AE(83.2%),因 AE 停药的共 5 例,其中 3 例(术后深静脉血栓、转氨酶升高、瘙痒症)被判定与药物相关。注射部位 AE 共 16 例(5.6%)。
Fitusiran 治疗期间出现的 TEAESI
肝脏安全性(转氨酶>3 倍 ULN)——共 10 例(3.5%),无症状,均自行缓解
血栓事件 —— 共 4 例(1.4%)
胆囊疾病 —— 共 16 例,与药物相关共 13 例(81.3%),9 例(56.3%)完全缓解
综上,AT-DR 在伴或不伴抑制物的 A 型及 B 型血友病患者中耐受性良好,并能够提供具有临床意义的出血保护,且每年仅需进行 6 次皮下注射。
2.5.1.2 主要疗效结果
总体人群中位 ABR 为 3.7(范围:0.0–7.5),无论受试者是否伴有抑制物,中位 ABR 均无明显差异(1.9 vs. 3.8)。
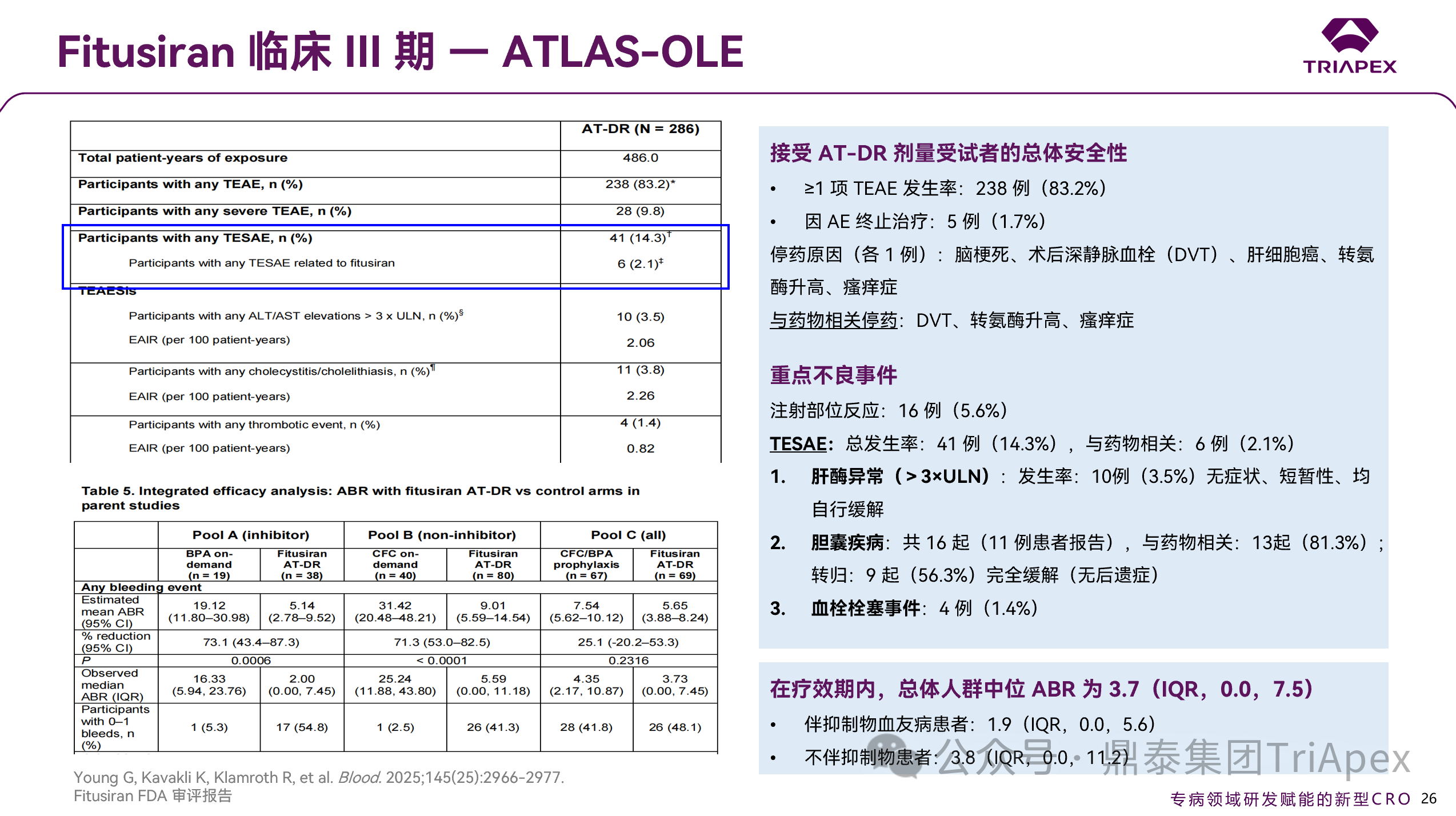
图 30. III 期临床(NCT03754790)安全性数据及主要疗效结果
2.5.2 支持制剂工艺变更的临床可比性研究策略
在 I 期至 III 期研究中,均使用了西林瓶制剂,但在 ATLAS-OLE 试验期间,考虑到部分受试者可能更偏好给药便利性,引入了预充笔(PFP)的给药方式。药品说明书最终也同时包含西林瓶和 PFP 两种制剂形式(PFP 用于递送 50 mg 固定剂量,西林瓶用于递送 20 mg 固定剂量)。当需将剂量减少至 20 mg 的患者,应从 PFP 切换至西林瓶制剂。从 PK 和疗效角度出发,申请人已在 PFP 和西林瓶制剂之间建立了科学桥接。
从 PK 角度来看,ATLAS-OLE 对通过 PFP 和西林瓶注射给药的 PK 参数进行了对比,先后接受 50 mg 的西林瓶、PFP 注射。两种制剂具有生物等效性,其最大血浆浓度、AUCₗₐₛₜ、AUC∞的 90% 置信区间均落在 80%-125% 的生物等效性范围内。
从疗效角度看,两种制剂的 ABR 同样具有可比性。

图 31. 西林瓶及 PFP 注射制剂的 ABR 对比
2.6 小结
支持产品上市的 III 期临床试验中(除 ATLAS-OLE),Fitusiran 治疗组的中位 ABR 均为 0.0,较传统 BPA/CFC 治疗方案显著降低患者(尤其是在伴抑制物患者中)出血风险,展现出疗效优势。以上 4 项 III 期试验中,AT 活性被持续抑制在 10-14% 区间,其抑制水平呈剂量依赖性,且不受抑制物状态影响。相比 AT-DR,固定剂量对 AT 活性抑制程度更高,可能部分解释 ATLAS-OLE 研究中观察到的 ABR 中位值(3.7)高于其他研究的现象。
4 项 III 期研究的总体安全性特征相似,常见不良反应包括肝酶升高、注射部位反应、胆囊疾病和血栓事件,Fitusiran 组的 TEAESI 发生率高于按需治疗组。鉴于血栓形成是大多数促凝药物的共性风险,ATLAS-INH、A/B、PPX 均通过修订"出血管理指南",同步探索剂量调整策略及个体化风险管理措施,以进一步优化获益-风险之间的平衡。由于ALT>1 倍 ULN 以及 AST>1-3 倍 ULN 的发生与 AT 活性抑制相关,且 AT 活性<10% 会诱发血栓风险,基于此,将目标 AT 活性范围设定为 15%–35% 可平衡 Fitusiran 的疗效与安全性。这一策略在 ATLAS-OLE,以及后续修订方案后的 III 期试验中,成功改善了血栓及肝酶升高的发生率。
监管互动里程碑[16]
3.1 End-of-Phase 2 (EOP2) Meeting
EOP2 会议中,申请人与 FDA 的核心议题在于现有及拟开展的 III 期临床试验是否能够支持 Fitusiran 上市申请。FDA 指出当前设计存在缺陷,需完善后方可推进 III 期研究,部分问题讨论如下:

图 32. EOP2 会议 FDA 主要观点
Q1:两项拟开展的关键 III 期临床研究均将纳入 A 型与 B 型血友病患者。此外,综合考虑血友病患者年龄分布及 Fitusiran 既有的 PK/PD 特征,均拟纳入≥12 岁青少年患者,FDA 是否同意采用该患者人群方案?
A1:鉴于非临床研究充分评估了幼龄动物中的毒性,同意纳入≥12 岁青少年受试者。基于所提交数据,Fitusiran 在无抑制物受试者中的中位 ABR 为 4.3 或 2.2,高于现有凝血因子替代疗法。且申请人未提供充分证据以说明为何将无抑制物患者从凝血因子预防治疗转为使用 Fitusiran 的依据。在推进 III 期试验之前,强烈建议补充以下关键数据及论证,以充分说明试验设计的科学性及 Fitusiran 的临床获益风险比:
1. 伴/不伴抑制物的 A 型或 B 型血友病患者群体的安全性及疗效数据;
2. 拟定的剂量策略对比分析(固定剂量 vs 基于体重给药);
3. 给药方案(基于 AT 降低>75% 的目标进行剂量调整)—— FDA 认为 75% AT 降幅临界值的设定依据不足,设定更高的 AT 降幅目标值(如>75%)可能实现更低的 ABR。
4. 高 ABR 患者随机分配至按需治疗组的合理性依据;
5. 从现有预防治疗转为 Fitusiran 治疗的临床合理性论证。
Q2:基于现有及计划开展的临床研究及预期安全数据库,是否足以支持 Fitusiran 注册上市?
A2:不足以支持 Fitusiran 上市。拟开展的 III 期临床研究中,申请人拟纳入的 B 型血友病患者(分别为≥5 例和≥20 例)及 12-18 岁青少年患者(分别为≥5例和≥8例)样本量不足,无法充分评估目标适应症的安全性与有效性。
3.2 Pre-NDA Meeting
2024年3月 FDA 与申请人召开的 Pre-NDA 会议的议题主要是针对2024年3/4月提交 NDA 所需临床数据包是否能够支持 NDA 申报,部分重点讨论问题如下:

图 33. Pre-NDA 会议信息
Q1:FDA 是否同意拟提交的临床数据包(疗效证据:ATLAS-INH、ATLAS-A/B;以及 ATLAS-PPX、ATLAS-OLE)能提供足够依据以支持 NDA 申报及审评要求?
A1:FDA 基于综合安全性及有效性数据,认可申请人所提方案在临床层面的合理性。同时,鉴于申请人计划上市的 AT-DR 剂量,FDA 明确要求:支持原始剂量(80 mg 每月一次)及 AT-DR 剂量疗效及安全性的临床研究报告与数据集中,必须区分受试者个体、给药方案和组别信息,不接受将接受不同给药方案的受试者数据笼统合并。此外,FDA 提醒,说明书须包含 AT-DR 剂量调整方案,并要求配套经临床验证的 AT 活性检测方法(检测限<15%),不得推荐任何未经验证的检测方法。同时警示,若药物上市时缺乏可实时监测 AT 活性的标准化检测设备,将导致重大用药风险。
免疫原性
Fitusiran 在非临床研究中未发现抗药物抗体(ADA)产生,临床 ADA 发生率较低,且多为诱导产生的一过性抗体,多数在后续治疗中转阴,均未影响 AT 抑制效果,考虑为人体特异性反应。总的来说,Fitusiran 在人体内的免疫原性风险较低。
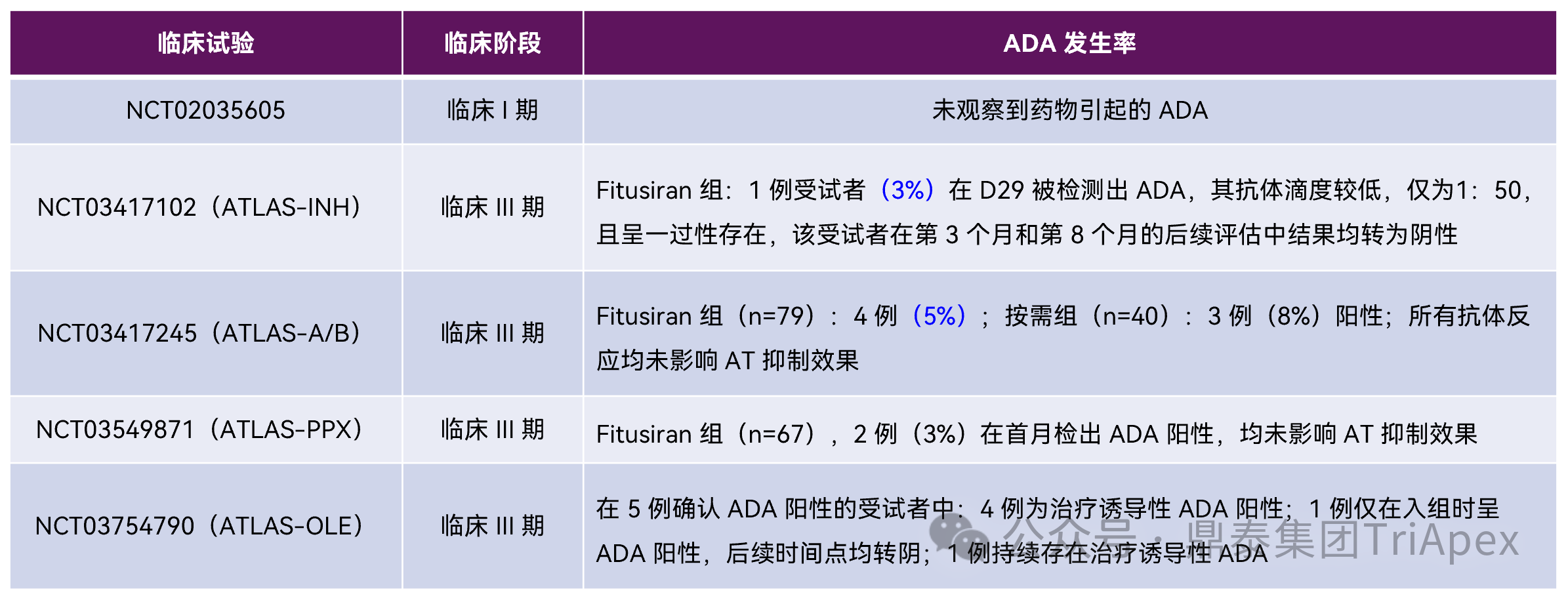
图 34. Fitusiran 临床上 ADA 发生率汇总
非临床与临床关联性分析
5.1 安全性
非临床毒性特征与临床出现的不良反应具有强关联性,主要包括过度凝血导致的血栓形成、肝酶升高、肝细胞坏死、肝内单核细胞浸润以及胆管增生/扩张 —— 可归纳为血栓风险与肝胆毒性。这类毒性与常规 siRNA 药物区别大,为 Fitusiran 药理作用相关的毒性风险。
需特别说明的是,非预期死亡动物中同时观察到血栓形成与全身性出血的“矛盾现象”,其机制可解释为体内大量微血栓的形成导致凝血因子过度消耗,引发继发性凝血因子耗竭,最终因凝血功能障碍造成多器官出血及死亡。
同时,大鼠与食蟹猴中发现的胰腺组织病理学改变(如腺泡萎缩、导管增生等)在临床试验中未见对应不良反应信号,提示此类风险可能具有动物种属特异性,在人体风险评估中临床相关性有限。
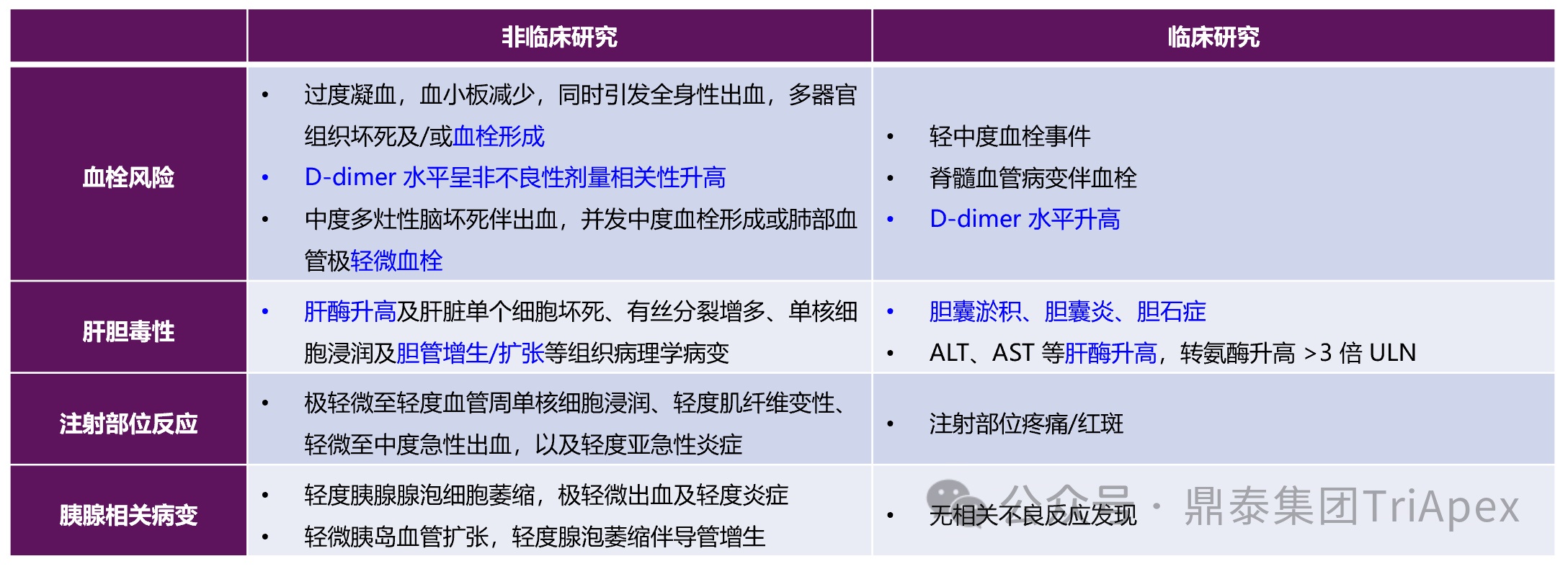
图 35. Fitusiran 非临床与临床毒性发现对比
5.2 药效学标志物
在 Fitusiran 的非临床研究中,药效学与毒理学研究同步监测了关键药效标志物变化,包括 AT mRNA 表达水平、AT 蛋白浓度及 AT 活性,部分研究还同时纳入凝血酶生成峰值的分析。这些数据不仅为临床研究中药效标志物的选择确立了科学基准,同时为基于 AT-DR 的风险管控策略提供了机制验证依据。
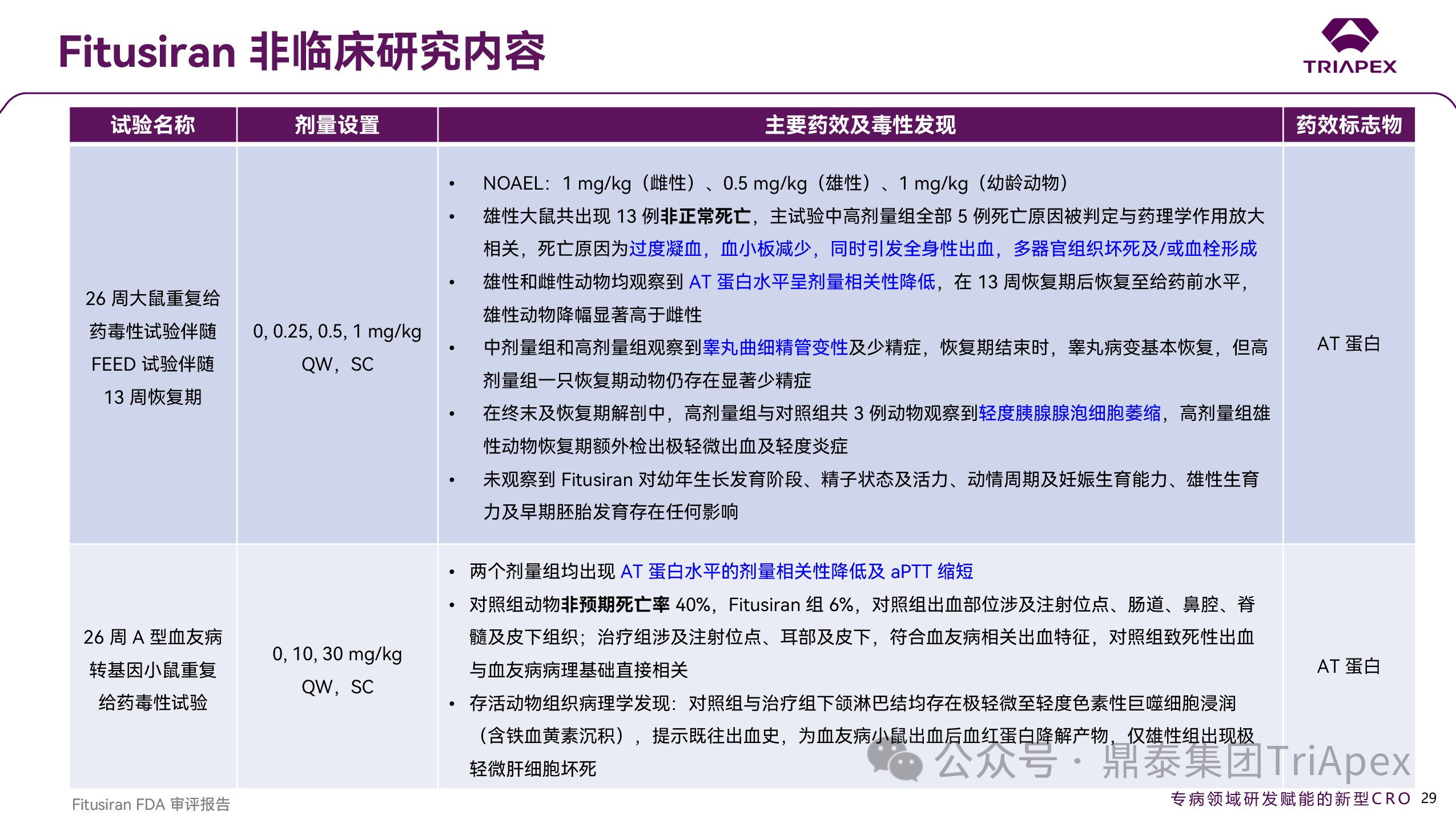
图 36. Fitusiran 非临床研究内容
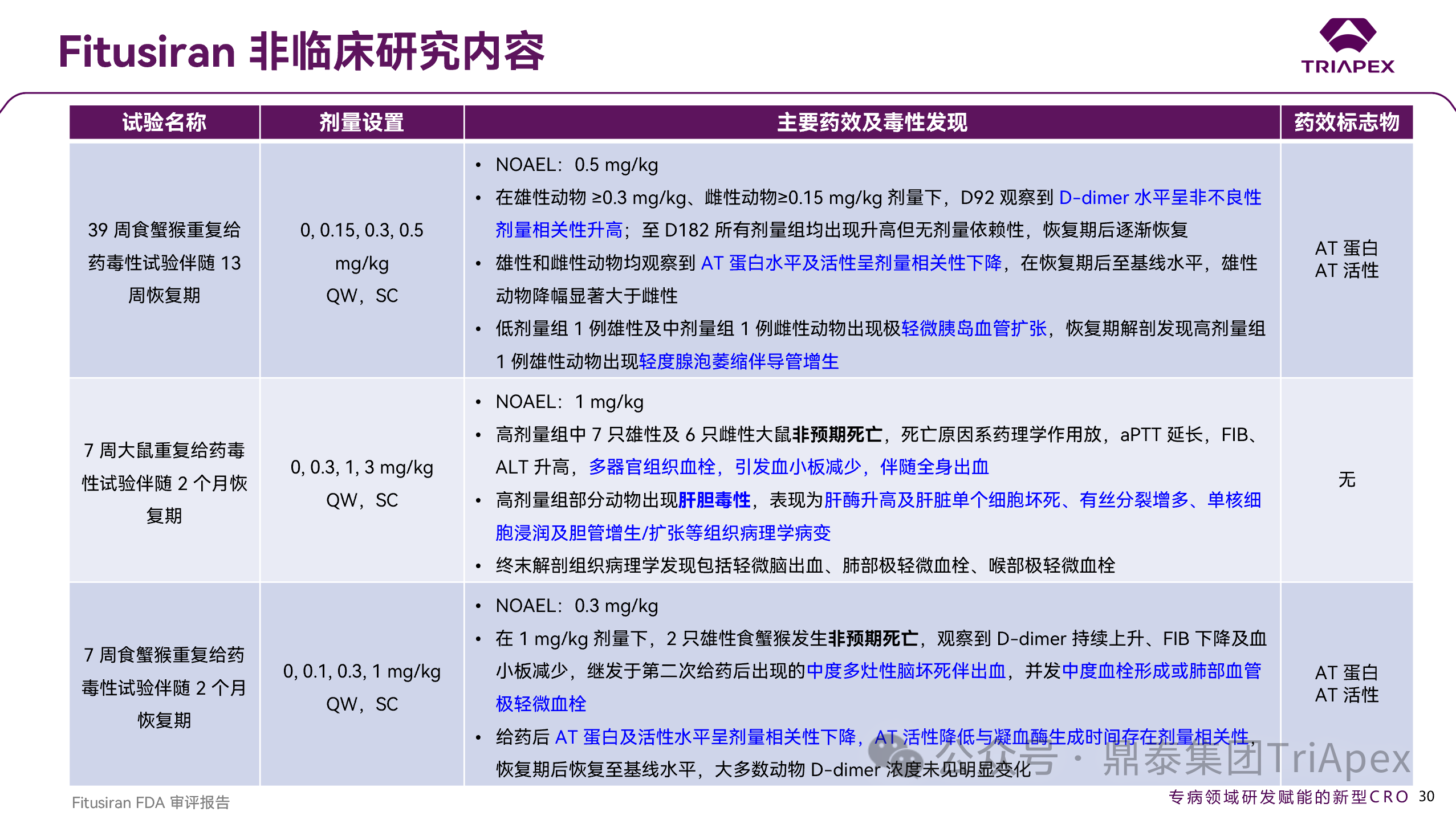
图 37. Fitusiran 非临床研究内容(续)
结语
作为全球首款获批用于血友病预防治疗的 siRNA 药物,Fitusiran 的上市历程及临床开发策略为灵活适应监管要求与科学评价提供了又一成功范例。其基于 AT 活性动态调整剂量的创新方案,突破了传统 siRNA 使用固定剂量的模式。通过在非临床和临床研究中积极探索 AT 活性随剂量变化的药效学规律及其与潜在毒性信号的关联,该方案最终实现了动态剂量优化与风险获益平衡管理。同时,申请人基于与监管机构的持续对话,充分采纳科学建议,创新性地在关键III期临床试验中根据抑制物状态进行患者分层,成功拓展了该药物在不同血友病患者亚群中的适用性。对 Fitusiran 上市历程的学习与分析,进一步深化了鼎泰团队在寡核苷酸药物研发领域的科学认知,有助于更好地指导研发实践,加速同类药物的研发进程。
后记:2024年5月,Fitusiran 上市申请获 CDE 受理并纳入优先审评,相信在不久的将来为中国患者带来福音。