
2025-08-27 11:32:21来源: 注册圈 药方舟浏览量:553
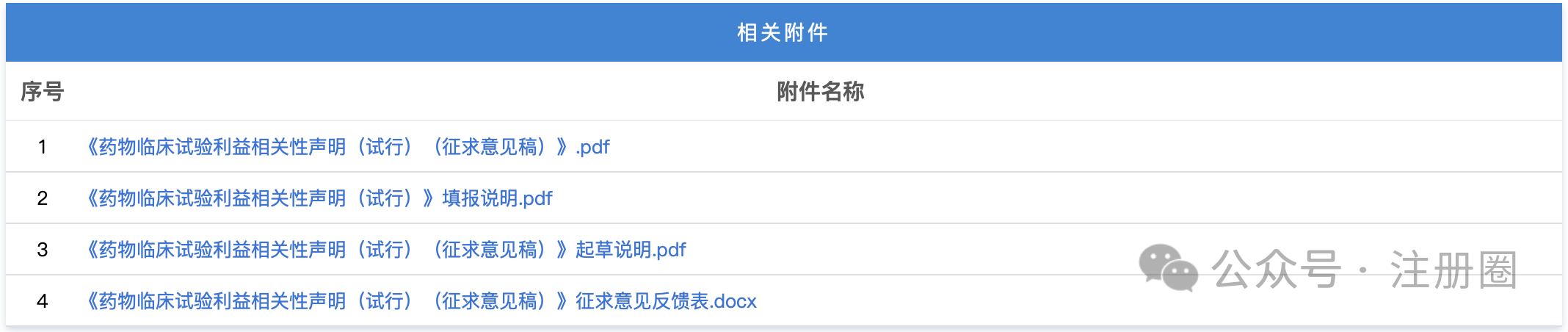
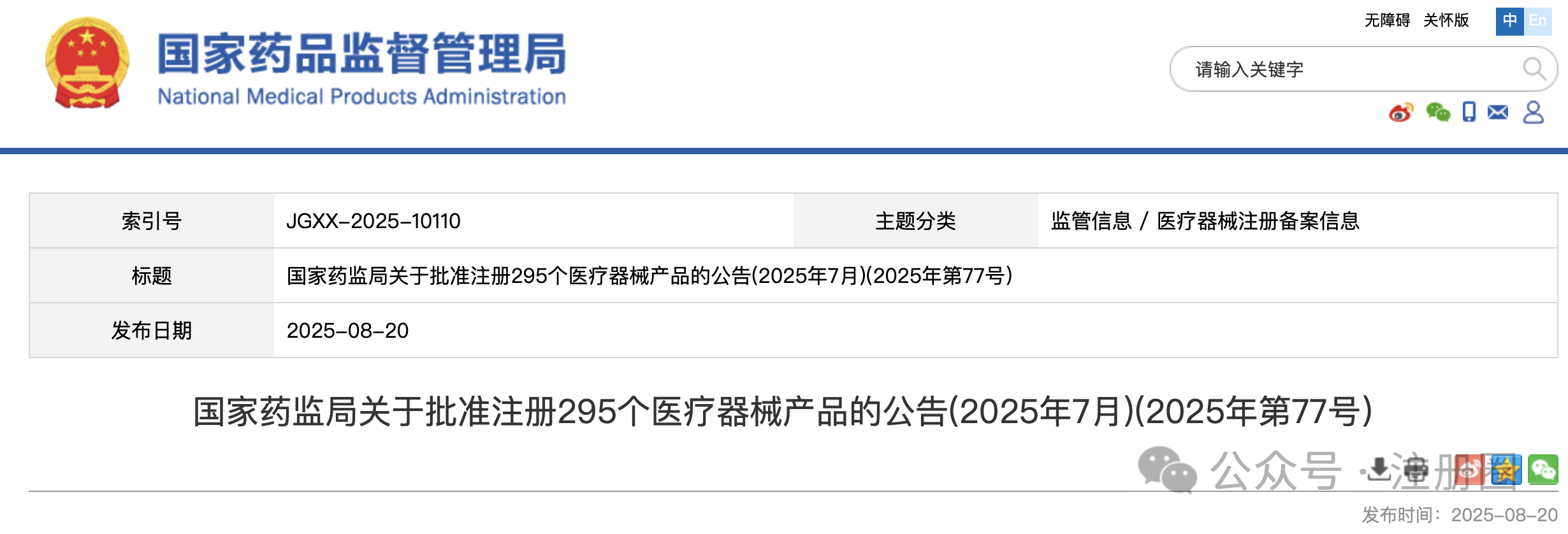
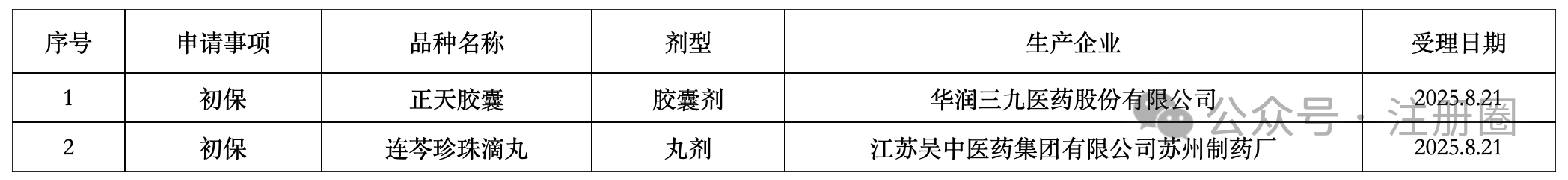
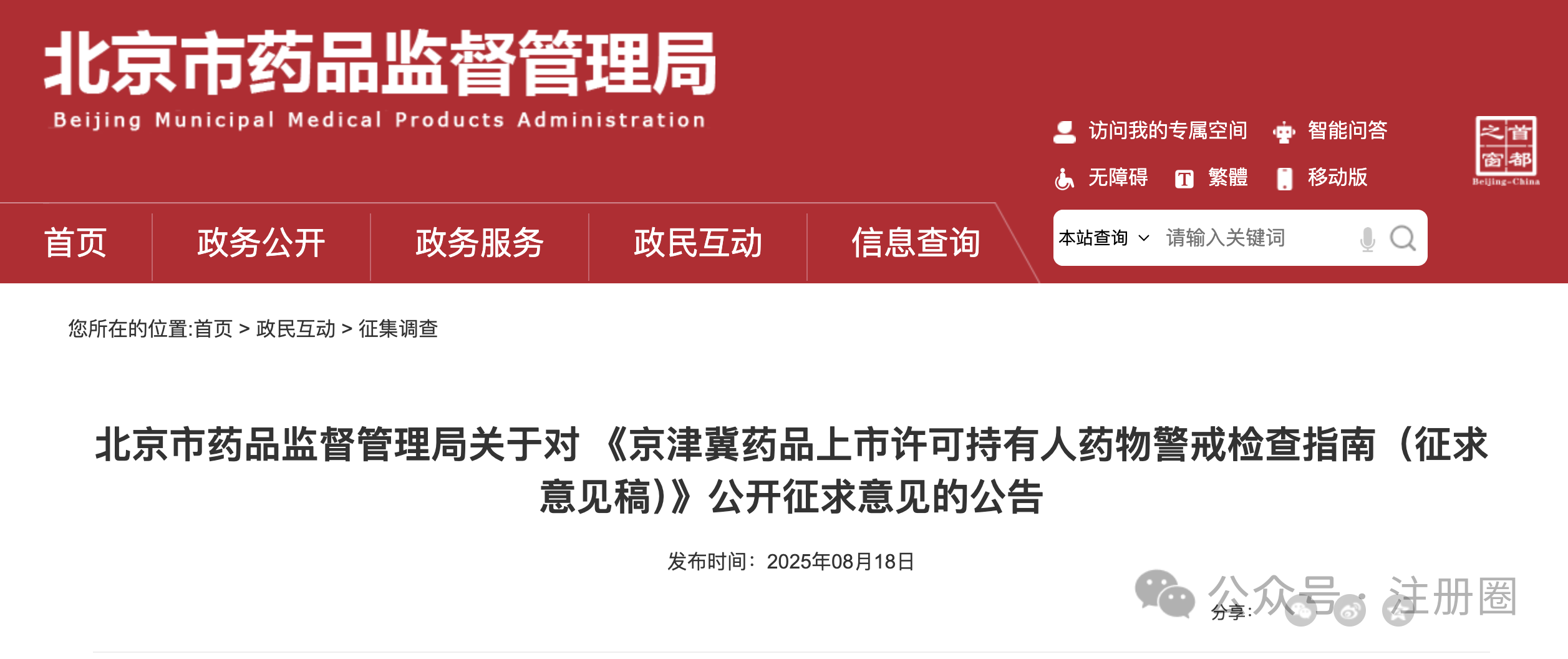
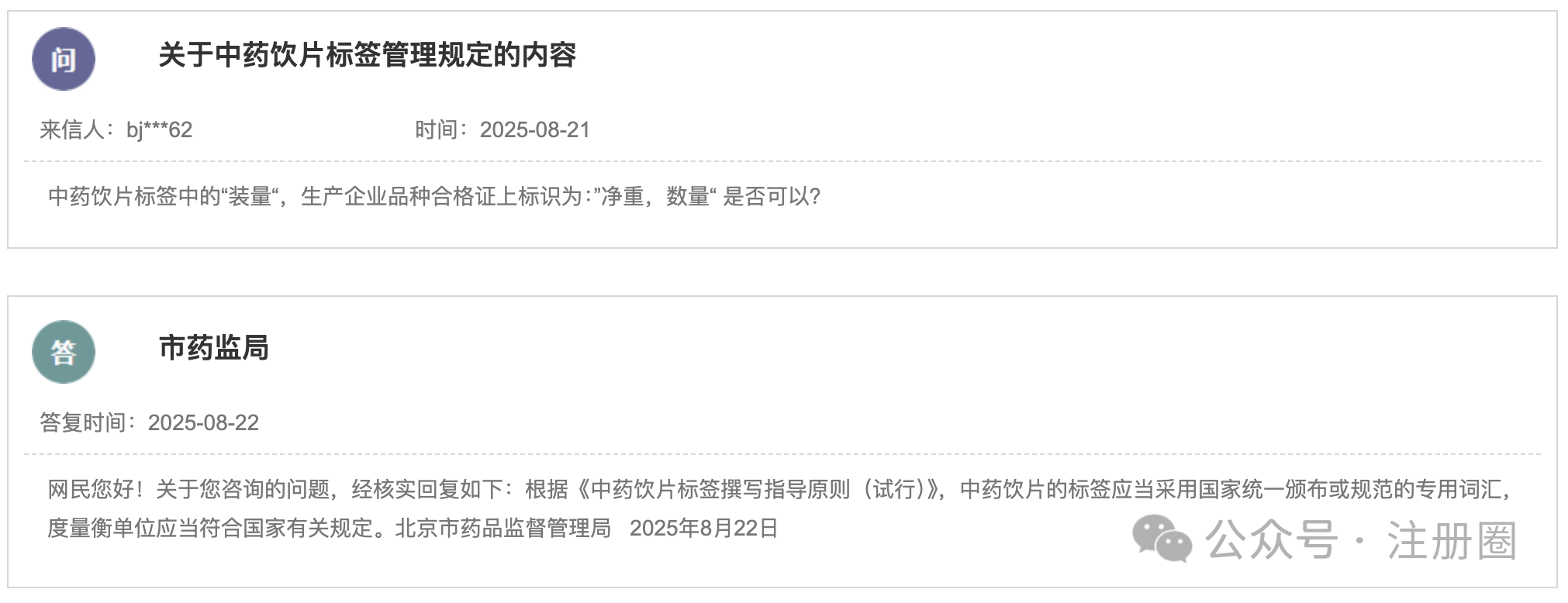
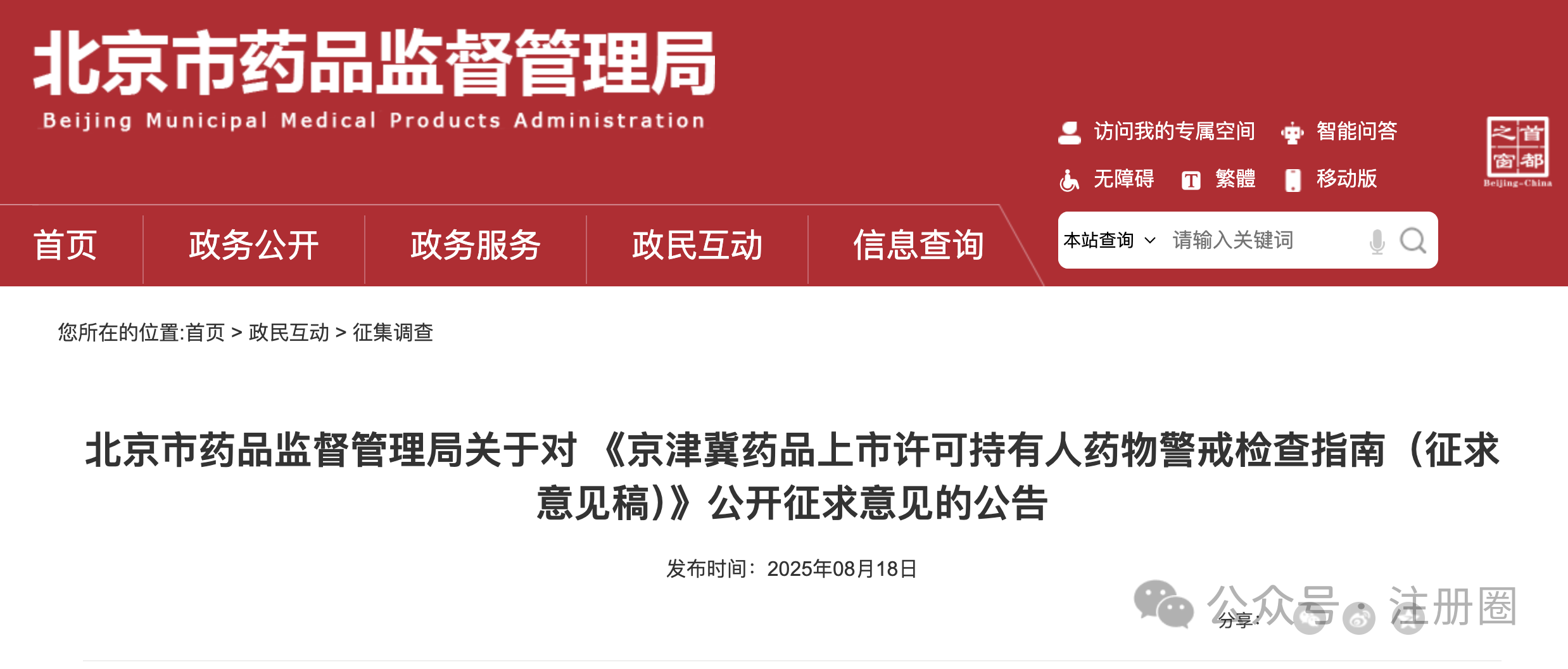
https://www.cde.org.cn/main/news/viewInfoCommon/8bc9e3c770557139c5f3d463cc26d3b5 为加强药物临床试验中的利益冲突的防范和管理,保证药物临床试验的实施和试验结果不受利益冲突的不当影响,营造良好药物研发生态,我中心组织起草了《药物临床试验利益相关性声明(试行)(征求意见稿)》,计划将其纳入药品注册申报资料要求,现公开征求意见。 诚挚欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们。征求意见时限为自发布之日起1个月。 请将您的反馈意见发送到以下邮箱: 联系人:刘艺迪、王淼 邮箱:liuyd@cde.org.cn,wangmiao@cde.org.cn 感谢您的参与和大力支持! 国家药品监督管理局药品审评中心 2025年8月20日 https://www.cde.org.cn/main/news/viewInfoCommon/90535766bf5cdad4590285791f35e197 我中心起草了《单臂临床试验用于支持抗肿瘤药物常规上市申请技术指导原则(征求意见稿)》,旨在为以单臂临床试验作为确证性研究支持抗肿瘤药物常规批准提供技术建议。 我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起一个月。 您的反馈意见请发到以下联系人的邮箱: 联系人:郝瑞敏 联系方式:haorm@cde.org.cn 感谢您的参与和大力支持。 国家药品监督管理局药品审评中心 2025年8月20日 https://www.cde.org.cn/main/news/viewInfoCommon/e8616987d14b6039fc492dbfdd7f9ab0 依据《儿童抗肿瘤药物研发鼓励试点计划(星光计划)申报指南》,现将拟纳入“星光计划”试点项目的基本信息予以公示,公示时间截至2025年8月28日。 品种名称:ICP-723口崩片 申报单位:北京诺诚健华医药科技有限公司 拟开发儿童适应症:携带神经营养酪氨酸受体激酶(NTRK)融合基因的实体瘤 如有异议,请将具体意见发送至邮箱:etdrugs@cde.org.cn。 国家药品监督管理局药品审评中心 2025年8月21日 https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxpzhzhcchpgg/20250820094827131.html https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20250821142508116.html https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20250821174547110.html 根据药品境外检查结果,国家药监局于2019年3月20日发布《国家药监局关于对印度法速达制药公司氯雷他定原料药暂停进口通关备案的公告》(2019年 第22号),决定暂停发放该产品的进口通关凭证。 法速达制药公司(Vasudha Pharm Chem Limited)进行整改后,向国家药监局提出恢复氯雷他定原料药进口通关备案的申请和有关注册补充申请。经国家药监局组织技术评定,认为该企业对药品境外生产现场检查发现的缺陷已整改完成。 依据《中华人民共和国药品管理法》《药品医疗器械境外检查管理规定》,国家药监局决定恢复进口法速达制药公司自相关补充申请获批之后生产的氯雷他定原料药(英文名:Loratadine)。 自本公告发布之日起,各药品进口口岸药品监督管理部门恢复发放上述产品的进口药品通关单。 特此公告。 国家药监局 2025年8月20日 https://www.nifdc.org.cn/nifdc/xxgk/ggtzh/pxtzh/202508221353491692885.html 各有关单位: 为贯彻落实《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》等有关规定,加强药用辅料、药包材质量标准和研发能力,中国食品药品检定研究院(以下简称中检院)定于2025年11月12日—14日在重庆市举办新规下药用辅料和药包材质控研发应用技术培训班。现将有关事项通知如下: 一、主办单位 中检院。 二、培训师资 本次培训拟邀请中检院、国家药典委员会、四川省药品检验研究院、上海市食品药品包装材料测试所、山东省医疗器械和药品包装检验研究院、重庆市食品药品检验检测研究院、国内知名科研院所及行业内知名专家授课。 三、培训对象 培训面向全国药品监管机构、检验检测机构、审评机构、研发机构、高等院校、科研院所、行业协会及药用辅料和药包材生产企业、药品生产企业等相关人员。 四、培训内容 (一)粉体流变特性在药用辅料质控中的应用。 (二)高端制剂中药用辅料功能性要求。 (三)药用辅料行业生产质量管理现状及检验相关要求。 (四)聚维酮系列产品标准关键技术解析及实施要点。 (五)药物制剂及辅料的结构与空间分布。 (六)眼用制剂辅料的研究进展。 (七)透皮给药制剂中药用辅料对药品渗透性的研究。 (八)药用辅料体内过程研究。 (九)眼科药物的基本评审思路及溶液型滴眼剂指导原则解读。 (十)《中国药典》2025年版药包材标准解读。 (十一)药用辅料和药包材的质量控制面临的挑战与应对。 (十二)包材特定残留物检验方法解析。 (十三)吸入制剂包材与辅料的质量评价与要求。 (十四)注射剂橡胶密封件的浸出物分析。 (十五)激光顶空气体分析技术及其在药品包装系统密封性研究中的应用。 (十六)药包材生物学安全性评价路径及方法。 (十七)药包材风险评估与案例分析。 注:具体培训内容以报名系统中公布的内容为准。 五、培训时间及地点 (一)报到时间:2025年11月11日11:00开始。 (二)培训时间:2025年11月12日—14日。 (三)报到地点:重庆奥格斯酒店管理有限公司(重庆机场诺富特酒店)。 (四)培训地点:重庆奥格斯酒店管理有限公司(重庆机场诺富特酒店3F多功能厅)。 六、培训方式 (一)培训形式 培训采取现场授课的形式开展。 (二)培训证书 培训结束后,学员可登录培训系统查看或下载培训证书。 1.移动端:学员可在“中国药检”微信公众号→“教育培训”→“中检云课”→“我的”→“我的证书”查看或下载培训证书。 2.电脑端:登录https://zjyk.nifdc.org.cn网址→“我的”→“我的证书”查看或下载培训证书。 七、报名程序 培训支持团队或个人方式报名。 (一)移动端:微信扫描下方二维码,登录后即可报名参加本次培训班。或关注“中国药检”微信公众号后,点击→“教育培训”→“中检云课”查看本次培训班信息并报名。 (二)电脑端:登录https://zjyk.nifdc.org.cn网址查看本次培训班信息并报名。 (三)本次培训名额有限,请尽快报名,满额即止。 (四)如遇不可抗力因素导致培训班延期或取消,届时将另行通知。 八、培训费用 (一)培训费 本次培训班培训费3100元/人(包括培训师资费、场地费、材料费、证书费、培训期间餐费以及其他费用)。 (二)培训费缴纳方式 1.在线支付 学员在公众号内提交报名信息后进入确认订单页,选择在线支付方式,点击提交跳转至在线支付,完成后在“已报名”或“我的”→“我的已报名”可查看。在线支付培训费不产生任何手续费,培训报名确认以最终缴费时间为准。 2.汇款支付 支持公对公汇款和个人汇款(柜台汇款和网银汇款等),为确保汇款及时到账,请参训学员务必在培训报到前确保将款汇出,并于汇款时标注“辅料包材培训+参训人姓名”。汇款支付报名需要上传支付凭证至中检云课平台,提交并经审核完成后,可在“已报名”或“我的”→“我的已报名”中查看。 收款单位:中国食品药品检定研究院 账号:0200001509089202642 开户行:中国工商银行北京永定门支行 开户行号:102100000152 (三)发票 本培训班开具培训费发票,分为电子发票(普通发票)、电子发票(增值税专用发票),请学员在报名时准确选择发票类型并认真填写发票信息。中检院确认收到培训款项后,最迟在培训结束后5个工作日内开具发票,学员可以通过以下方式查看开票状态和下载发票。 1.移动端:学员可在“中国药检”公众号→“教育培训”→“中检云课”→“我的”→“我的发票”查看相关信息。 2.电脑端:登录https://zjyk.nifdc.org.cn网址→“我的”→“我的发票”查看相关信息。 九、其他事项 (一)本次培训住宿费用自理,参训学员自行与酒店进行预订、结算等事宜,住宿费发票由重庆奥格斯酒店管理有限公司开具。参训学员也可自行选择周边其他酒店预订。 1.重庆奥格斯酒店管理有限公司(重庆机场诺富特酒店)(本次培训优惠价格): (1)标准间,双床,370元/晚(含2早); (2)大床房,单床,370元/晚(含1早); (注:如需拼住房预定,请学员事先自行确定拼房同住人,拼住期间房费平分;预订酒店时,如酒店房型短缺情况,酒店可推荐其他房型。) 2.本次培训预留房源有限,预订从速,无房源情况下参训学员自行解决。 (二)本次培训不安排接送站,请学员自行前往酒店,交通费用自理。 十、联系方式 (一)中检院培训中心 林老师,电话:010-53851330,手机:13522385709 孟老师,电话:010-53851495,手机:13051466801 (二)培训报名技术支持 系统报名操作等相关问题咨询:李老师18834135839 (三)重庆奥格斯酒店管理有限公司(重庆机场诺富特酒店) 酒店地址:重庆市渝北区两路街道机场东二路21号 谢经理,手机:18523163112 中检院办公室 2025年8月22日 (一)北京市药品监督管理局关于对 《京津冀药品上市许可持有人药物警戒检查指南(征求意见稿)》公开征求意见的公告 网址: https://yjj.beijing.gov.cn/yjj/zwhd17/zjdc38/743734544/index.html 为贯彻落实《药物警戒质量管理规范》要求,推动京津冀三地药物警戒检查标准统一,北京市药品监督管理局、天津市药品监督管理局、河北省药品监督管理局结合区域实际,共同起草了《京津冀药品上市许可持有人药物警戒检查指南》(附件1),现向社会公开征求意见,欢迎社会各界提出意见建议。 公开征集意见时间为:2025年8月18日至9月17日。 意见反馈渠道如下: 1.电子邮件:填写意见反馈表(附件3),发送至bjadryp1@yjj.beijing.gov.cn,邮件主题请注明“药物警戒检查指南意见反馈”。 2.邮寄通信地址:填写意见反馈表(附件3),邮寄至北京市通州区留庄路6号院2号楼623室,北京市药品监督管理局药品不良反应监测中心,邮政编码:101100,请在信封上注明“药物警戒检查指南意见反馈”字样。 3.电话:010-55527162。 4.登录北京市人民政府网(http://www.beijing.gov.cn),在“政民互动”版块下的“政策性文件意见征集”专栏中提出意见。 附件:1.《京津冀药品上市许可持有人药物警戒检查指南(征求意见稿)》.docx 2.《京津冀药品上市许可持有人药物警戒检查指南(征求意见稿)》起草说明.doc 3.《意见反馈表》.doc 北京市药品监督管理局 2025年8月18日 (二)新增1个共性问题 网址: https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/bjah-index-dept!detail.action?originalId=AH25082101514 (三)北京市药品监督管理局关于对 《京津冀药品上市许可持有人药物警戒检查指南(征求意见稿)》公开征求意见的公告 网址: https://yjj.beijing.gov.cn/yjj/zwhd17/zjdc38/743734544/index.html 为贯彻落实《药物警戒质量管理规范》要求,推动京津冀三地药物警戒检查标准统一,北京市药品监督管理局、天津市药品监督管理局、河北省药品监督管理局结合区域实际,共同起草了《京津冀药品上市许可持有人药物警戒检查指南》(附件1),现向社会公开征求意见,欢迎社会各界提出意见建议。 公开征集意见时间为:2025年8月18日至9月17日。 意见反馈渠道如下: 1.电子邮件:填写意见反馈表(附件3),发送至bjadryp1@yjj.beijing.gov.cn,邮件主题请注明“药物警戒检查指南意见反馈”。 2.邮寄通信地址:填写意见反馈表(附件3),邮寄至北京市通州区留庄路6号院2号楼623室,北京市药品监督管理局药品不良反应监测中心,邮政编码:101100,请在信封上注明“药物警戒检查指南意见反馈”字样。 3.电话:010-55527162。 4.登录北京市人民政府网(http://www.beijing.gov.cn),在“政民互动”版块下的“政策性文件意见征集”专栏中提出意见。 附件:1.《京津冀药品上市许可持有人药物警戒检查指南(征求意见稿)》.docx 2.《京津冀药品上市许可持有人药物警戒检查指南(征求意见稿)》起草说明.doc 3.《意见反馈表》.doc 北京市药品监督管理局 2025年8月18日



2025年8月19日




声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容