![]()
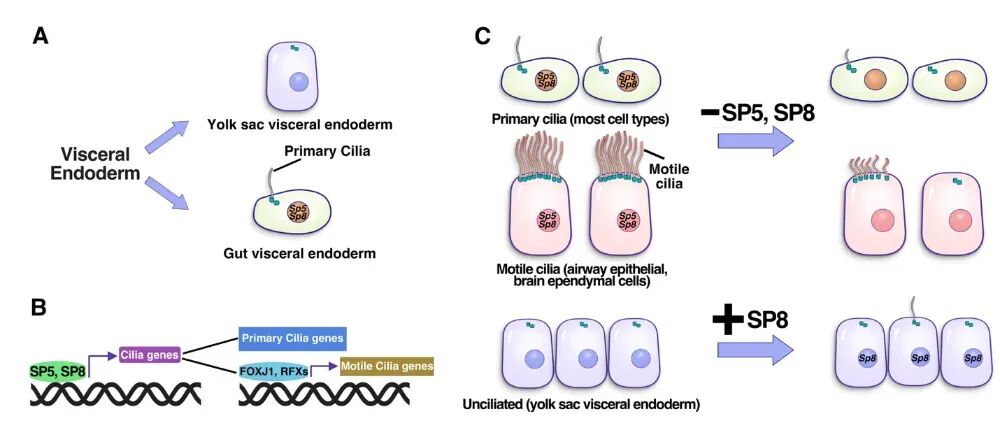
点评丨潘俊敏(清华大学教授)、周军(南开大学生命科学学院教授)看起来像一根手指,又像一条头发丝,在研究纤毛的科学家眼中,它更像是一根“天线”。这种被称为初级纤毛 (Primary cilium) 的重要细胞器结构,存在于人体大多数细胞表面,却长期缺席于教材插图中。20 多年前,纪念斯隆-凯特琳癌症中心科学家 Kathryn V. Anderson 首次报导初级纤毛的重要功能:负责接收和处理胚胎发育中的关键信号Hedgehog (Hh) 信号,控制神经系统和多器官的形成【1】。纤毛缺陷导致一系列人类纤毛疾病综合征,包括不孕、听力障碍、腭裂,脑积水、多指、内脏反位等【2, 3】。然而,有一个核心谜题一直悬而未解:细胞如何启动纤毛形成?尤其是驱动初级纤毛形成的转录因子(TF)长期以来尚不明确。2025年8月28日,纪念斯隆-凯特琳癌症中心(MSKCC)的Alexandra L. Joyner 研究团队 (资深科学家梁银文博士是第一作者及共同通讯作者) 在Science杂志以长文形式发表了题为Transcription factors SP5 and SP8 drive primary cilia formation in mammalian embryos 的研究论文。研究团队以小鼠胚胎和干细胞为模型,鉴定到同一家族的两个转录因子 SP5 和 SP8 如同开关一样决定了细胞是否启动纤毛的形成。这一发现解决了领域内的核心谜题,揭示了由SP5 和 SP8调控的基因调控网络如何快速、特异性地介导纤毛的形成,为纤毛疾病的治疗带来重要指导意义。从基因表达、表观遗传到“纤毛发生的开关”-转录因子虽然在人体和胚胎发育过程中多数细胞有纤毛,少数细胞不具有纤毛。既往研究显示纤毛的形成具有谱系特异性,即来自胚胎外谱系的细胞,包括原生内胚层 (visceral endoderm) 和滋养外胚层 (trophectoderm) 细胞,缺乏纤毛,而胚胎内谱系 (epiblast) 在原肠胚早期开始形成并维持纤毛结构【4】。非常有意思的是,研究人员发现由原生内胚层分化而来一群细胞,最终发育形成肠管上皮细胞,称为内脏原生内胚层 (gut visceral endoderm, GutVE) 能够形成纤毛,而与之对应的姐妹谱系细胞-卵黄囊内胚层细胞 (yolk sac visceral endoderm, YsVE) 则无纤毛。研究团队以此现象为切入点,首先运用单细胞转录组测序 (scRNA-seq) 对比分析了小鼠胚胎早期的3种有纤毛细胞 (GutVE和2种胚胎内谱系来源的细胞) 与无纤毛细胞YsVE的转录组。结果显示上百个与纤毛结构、发生相关的基因 (shared cilia genes) 在所有的有纤毛细胞中高表达,在无纤毛细胞中低表达。其次,研究人员利用转座酶可及性染色质测序 (ATAC-seq) 技术分析这些shared cilia genes基因位点的染色质可及性,发现有超过一半 (n=70) 的染色质区域 (203 peaks) 在有纤毛细胞中更加显著增强 (开放)。通过对这些区域DNA序列进行TF结合基序分析 (motif analysis),研究团队成功鉴定到SP/KLF家族转录因子,其TF结合基序高度富集在这些染色质开放区域中。SP/KLF家族多个成员在胚胎发育过程中发挥关键作用,在哺乳动物中共有26个家族成员。研究者通过对整个家族的基因进行表达谱筛选,发现早期小鼠胚胎中仅有Sp5和Sp8基因特异性高表达于有纤毛细胞,而在无纤毛细胞中处于沉默状态。进一步,研究人员在小鼠胚胎干细胞中利用染色质免疫共沉淀测序 (ChIP-seq) 系统分析了SP5和SP8蛋白在全集因组内的结合位点,总共鉴定出187个纤毛相关基因可被SP5或SP8直接结合。这些底物纤毛基因编码的蛋白参与了纤毛的构成和组装、功能,而且很多基因已被报道为纤毛疾病的致病基因。基此,研究团队构建了Sp5和Sp8双敲除的体外囊胚体 (gastruloid),通过与对照组的转录组比较,发现随着Sp5和Sp8的敲除大部分靶向纤毛基因的表达显著下降,证实了SP5和SP8对纤毛基因表达的直接激活调控。研究团队进一步构建了组织特异性敲除小鼠模型,发现敲除Sp5和Sp8后,胚胎早期的各胚层的细胞中纤毛的形成和维持均有缺陷;并导致胚胎中后期死亡伴随露脑、尾部短缺、神经管缺陷、内脏反位、少指等多器官发育缺陷,提示SP5和SP8介导纤毛合成的通路在胚胎和器官发育中的多重功能。转录因子Forkhead与RFX家族成员在多纤毛 (运动纤毛) 形成过程中发挥关键作用【5】。研究团队通过信息学方法比对发现这些转录因子的motif与SP家族motif有部分重叠。而且SP8能够结合至这些转录因子基因的启动子区域。Sp5和Sp8单倍剂量不足小鼠 (haploinsufficient mice,Sp5-/-;Sp8-/+) 则出现出生后致死性状,伴随严重脑积水,以及脑室、气管中运动纤毛缺陷。因此,SP5和SP8或通过激活多纤毛转录因子调控运动纤毛的形成。特别激动的是,研究人员还发现过表达Sp8足以驱动纤毛的形成,可逆转无纤毛细胞的命运。研究团队结合scRNA-seq及转录子活性分析,发现Sp8过表达可显著上调靶向的纤毛基因,也包括运动纤毛的转录因子FOXJ1和RFXs的表达。因此,SP5和SP8作为核心调控因子,激活下游纤毛基因调控模块。这一发现阐明了纤毛发生转录调控网络的全新层级关系与调控模式,明确了SP5和SP8在纤毛基因调控网络中的枢纽作用,同时也为研究团队后续系统性解析纤毛转录调控网络提供了坚实的理论基础与研究方向。研究者还发现该调控机理独立于细胞周期的调控,颠覆了传统认知的长G0、G1期促进纤毛的发生。综上,这项研究首次在胚胎中揭示了SP5和SP8两个转录因子驱动纤毛形成的基因网络,并从体内、外水平实现“增益转录因子改变细胞纤毛的命运”,具有重要的机制学价值和极高的医学转化潜力,为安全、有效调控纤毛的发生,进而治疗纤毛缺陷疾病提供了新策略。本文的第一作者为Alexandra L. Joyner课题组的资深科学家梁银文博士,本研究受到NIH、NCI、Cycle for Survival基金资助,参与作者包括MSKCC Alexandra L. Joyner课题组成员,Richard Koche博士、Kathryn V. Anderson博士、Anna-Katerina Hadjantonakis博士、康奈尔大学医学院黄晓峰博士,NCI Terry P. Yamaguchi课题组成员等。梁银文博士和Alexandra L. Joyner博士为本文的共同通讯作者。纤毛可以笼统分为成簇的运动纤毛和多数不动的以单根存在的初级纤毛。纤毛具有运动、感知和信号传导的功能,在人体发育和生理稳态中发挥重要的作用,其在组装和信号传导的缺陷可导致一系列的疾病,统称为纤毛病。纤毛形态建成的机制虽然有了很多进展,比如在衣藻中最先发现的鞭毛内运输机制,参与几乎所有生物个体中的纤毛发生,但是哪些转录因子调控初级纤毛的发生是长期困扰纤毛领域的问题,这关系到细胞命运的决定。在小鼠胚胎发育过程中,科研人员发现有些来自同一谱系的细胞,一类细胞形成纤毛而另一类不形成纤毛。研究团队利用这一特殊的发育现象,进行了详细深入细致的研究和验证,最后成功的鉴定到了调控初级纤毛的转录因子SP5 和SP8,其同时也参与调控运动纤毛的发生。这是一个具有里程碑意义的重大发现,未来有望纳入教科书。周军 (南开大学生命科学学院遗传学和细胞生物学系教授)纤毛作为细胞重要的细胞器,在运动、感知和信号转导中发挥关键作用。纤毛发生的转录调控是该领域的重要科学问题,尤其是初级纤毛的转录调控机制仍不清晰。既往研究受限于缺乏合适的研究模型及系统性的多组学分析。本研究选题新颖,通过对早期胚胎的深入分析,建立了姐妹谱系细胞 (分别具有或缺乏纤毛) 的对比模型,并结合高精度的转录组与表观遗传学方法以及遗传学实验证据,最终鉴定出转录因子SP5 和SP8在初级纤毛及运动纤毛发生中的关键调控作用。这一发现具有重要的原创性和突破意义。特别是单一转录因子 (SP8) 能在无纤毛细胞中驱动纤毛的形成,展现出“”纤毛命运开关“的潜力;特别强调的是,这是首例在老鼠胚胎囊胚期运用生物学方法诱导纤毛形成的研究。此外,SP5 和 SP8 功能缺失所导致的脑裂、内脏反转、脑积水等典型纤毛病表型,直接将这一机制与人类纤毛疾病相联系。本研究工作显著拓展了人们对细胞器的转录调控及纤毛疾病分子机制的理解,也为纤毛疾病的治疗提供了重要的的理论依据。原文链接:DOI: 10.1126/science.adt5663
1. D. Huangfu D, Liu A, Rakeman AS, Murcia NS, Niswander L, Anderson KV. Hedgehog signalling in the mouse requires intraflagellar transport proteins. Nature. 2003 Nov 6;426(6962):83-7. doi: 10.1038/nature02061. PMID: 14603322.2.Goetz SC, Anderson KV. The primary cilium: a signalling centre during vertebrate development. Nat Rev Genet. 2010 May;11(5):331-44. doi: 10.1038/nrg2774. PMID: 20395968.3. Reiter JF, Leroux MR. Genes and molecular pathways underpinning ciliopathies. Nat Rev Mol Cell Biol. 2017 Sep;18(9):533-547. doi: 10.1038/nrm.2017.60. PMID: 28698599.4. Bangs FK, Schrode N, Hadjantonakis AK, Anderson KV. Lineage specificity of primary cilia in the mouse embryo. Nat Cell Biol. 2015 Feb;17(2):113-22. doi: 10.1038/ncb3091. PMID: 25599390.5. Choksi SP, Lauter G, Swoboda P, Roy S. Switching on cilia: transcriptional networks regulating ciliogenesis. Development. 2014 Apr;141(7):1427-41. doi:10.1242/dev.074666. PMID: 24644260.
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容