
2025-09-09 09:54:18来源:药方舟 注册圈浏览量:810
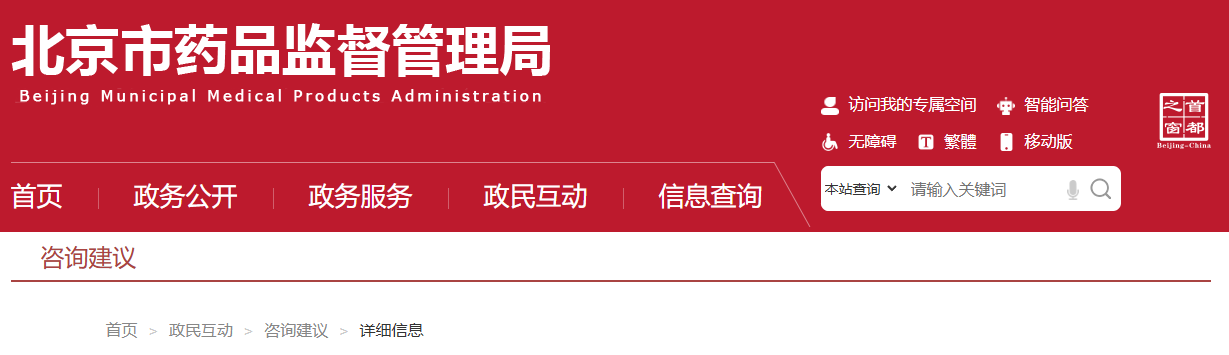
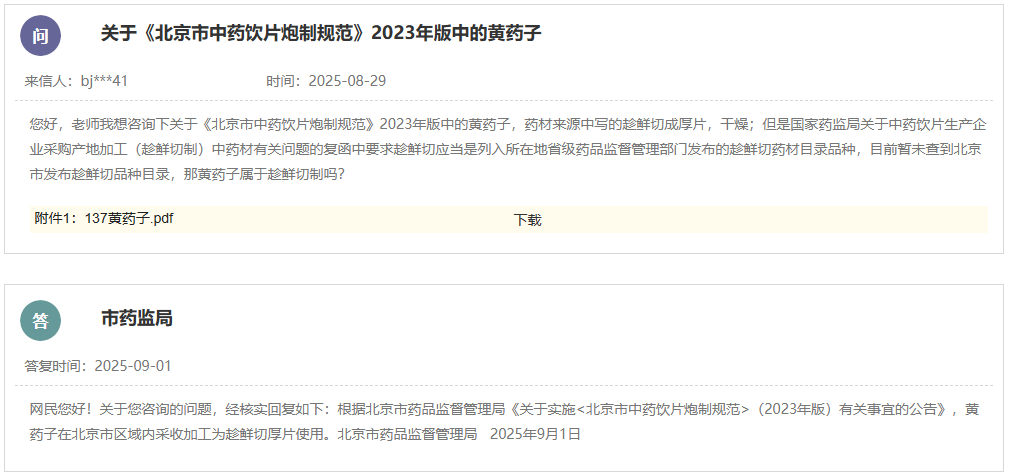
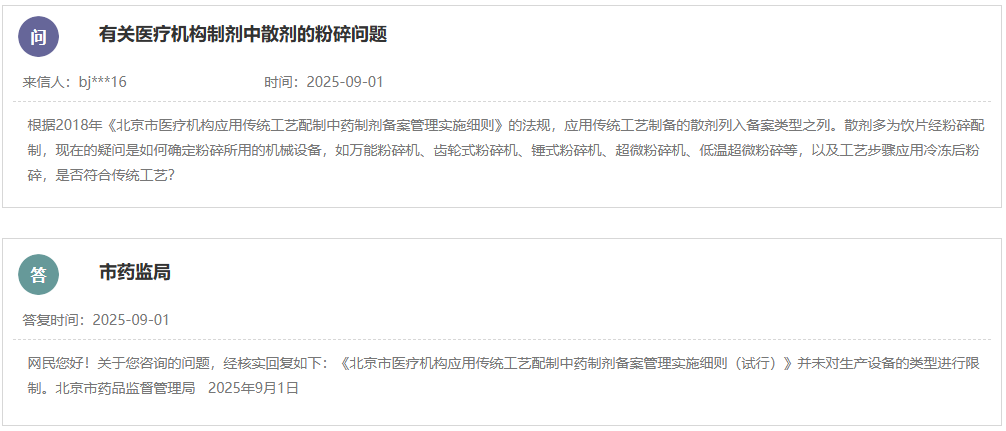
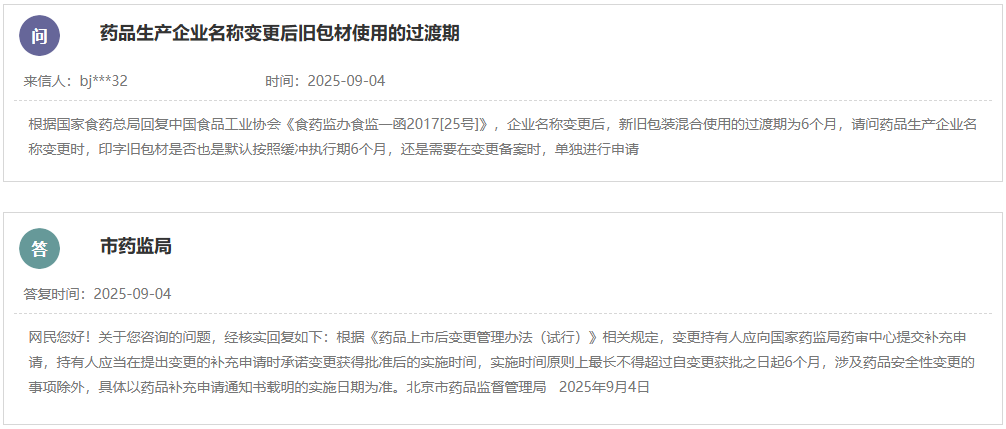
网址: https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxhybzhgg/20250901091117100.html 为进一步优化医疗器械标准体系,国家药品监督管理局决定废止YY/T 1000.1—2005《医疗器械行业标准的制定 第1部分:阶段划分、代码和程序》等5项医疗器械行业标准,现予以公布(见附件)。 附件:医疗器械行业标准废止信息表 国家药监局 2025年8月26日 二、国家药监局关于发布YY/T 0661—2017《外科植入物 半结晶型聚丙交酯聚合物和共聚物树脂》等3项医疗器械行业标准修改单的公告(2025年第81号) 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxhybzhgg/20250901092502116.html YY/T 0661—2017《外科植入物 半结晶型聚丙交酯聚合物和共聚物树脂》等3项医疗器械行业标准第1号修改单已经审定通过,现予以公布。标准修改单内容及实施日期见附件。 附件: 1.YY/T 0661—2017《外科植入物 半结晶型聚丙交酯聚合物和共聚物树脂》医疗器械行业标准第1号修改单 国家药监局 2025年8月26日 三、国家药监局综合司关于《采用脑机接口技术的医疗器械 RACA机器人运动意图编解码性能测试方法》推荐性医疗器械行业标准立项的公示 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxhybzhgg/20250902110922113.html 根据《医疗器械标准管理办法》《医疗器械标准制修订工作管理规范》要求,国家药监局经公开征求意见和组织专家论证,确定了《采用脑机接口技术的医疗器械 RACA机器人运动意图编解码性能测试方法》推荐性医疗器械行业标准制订计划,现予以公示。公示期间,如有异议,请向国家药监局反馈。 公示时间:国家药监局发布该公示之日起7日 电子邮箱:mdct@nmpa.gov.cn 附件:医疗器械推荐性行业标准制修订项目计划 国家药监局综合司 2025年8月29日 四、国家药监局关于发布仿制药参比制剂目录(第九十五批)的通告(2025年第33号) 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20250902145508155.html 经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第九十五批)。 特此通告。 附件:化学仿制药参比制剂目录(第九十五批) 国家药监局 2025年8月29日 五、国家药监局关于注销全自动医用PCR分析仪等2个医疗器械注册证书的公告(2025年第83号) 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20250904170633184.html 按照《医疗器械监督管理条例》的规定,根据企业申请,国家药品监督管理局现注销以下2家企业共2个产品的医疗器械注册证: 一、 深圳华大因源医药科技有限公司的1个产品:全自动医用PCR分析仪,注册证编号:国械注准20233221432。 二、 宁波天益医疗器械股份有限公司的1个产品:一次性使用滴定管式输液器 带针,注册证编号:国械注准20163141122。 特此公告。 国家药监局 2025年8月29日 https://www.cfdi.org.cn/cfdi/resource/news/16484.html 为进一步指导GLP机构规范开展GLP认证申请,核查中心针对认证申请受理、资料审查和现场检查中存在的一些常见的共性问题,对原《关于药物非临床研究质量管理规范认证申请和检查相关问题的解答》(以下简称《解答》)进行了修订(见附件),经国家药品监督管理局同意,现予发布。同时原《解答》废止,特此通告。 附件:关于药物非临床研究质量管理规范认证申请和检查相关问题的解答.pdf 国家药监局核查中心 二、新增1个共性问题 网址: https://www.cfdi.org.cn/cfdi/index?module=A004&m1=10&m2=&nty=STA024&tcode=STA026 咨询内容:老师 您好!我公司生产的药品为终端灭菌产品,灌装区域采用的是C+A层流,设备带环境在线监控设备,尘埃粒子设置纠偏限度大于等于0.5微米的为3000,大于等于5.0微米的为20。我的问题一:C+A层流是否必须要在线监控,是否有法规规定。问题二:验证过程中,C+A层流在人为干预下,超标的情况会偶尔出现,查找无菌附录中第十条 应当按以下要求对洁净区的悬浮粒子进行动态监测:(二)在关键操作的全过程中,包括设备组装操作,应当对A级洁净区进行悬浮粒子监测。生产过程中的污染(如活生物、放射危害)可能损坏尘埃粒子计数器时,应当在设备调试操作和模拟操作期间进行测试。A级洁净区监测的频率及取样量,应能及时发现所有人为干预、偶发事件及任何系统的损坏。灌装或分装时,由于产品本身产生粒子或液滴,允许灌装点≥5.0μm的悬浮粒子出现不符合标准的情况。是否可以通过评估,在人为干预过程中环境粒子超标,作为异常处理,不进入偏差处理。谢谢。 回复:您好。问题的背景是药品为终端灭菌产品,灌装区域采用的是C+A层流。附录1“无菌药品”中的生产操作示例只是为企业选择合理的生产操作环境提供参考,实际企业可按附录1“无菌药品”第七条 的规定,“根据产品特性、工艺和设备等因素,确定无菌药品生产用洁净区的级别。每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或处理的物料被微粒或微生物污染的风险。”因此,企业可以根据第七条的原则对相同的生产操作选择不同洁净度级别的环境。生产高污染风险的最终灭菌产品的,如果企业对灌装区采用C级背景下的A级送风,也可以被接受。对A级送风区域不需要做悬浮粒子的连续监测。值得注意的是,洁净度标准不仅仅有悬浮粒子,还需要监测微生物。对于悬浮粒子,灌装或分装时,由于产品本身产生粒子或液滴,允许灌装点≥5.0μm的悬浮粒子出现不符合标准的情况。无论该情形是作为异常还是偏差处理,重要的是评估超标情况对产品的影响,保证产品不受污染。 https://www.cfdi.org.cn/cfdi/resource/news/16488.html 为进一步提升我国药物临床试验生物样品分析质量和管理水平,核查中心组织修订了《药物临床试验生物样品分析实验室管理指南》(见附件)。经国家药品监督管理局同意,现予发布并自发布之日起施行。同时,原《药物临床试验生物样品分析实验室管理指南(试行)》废止。 特此通告。 附件: 《药物临床试验生物样品分析实验室管理指南》.pdf 国家药监局核查中心 一、山东省药品监督管理局 (一)省发改委关于药品和医疗器械产品注册收费标准的批复 网址: http://mpa.shandong.gov.cn/col/col101747/art/2025/art_c3dbee066460468c87db26226c555561.html 二、江苏省药品监督管理局 (一)关于征求《长三角药品监管领域不予行政处罚清单》(征求意见稿)意见的通知 网址: http://da.jiangsu.gov.cn/art/2025/9/2/art_84644_11633536.html 为深入推进长三角地区药品监管一体化发展,落实长三角市场监管一体化发展 2025 年工作要点,三省一市药品监督管理局经充分研讨,由安徽省局牵头起草了《长三角药品监管领域不予行政处罚清单》(征求意见稿),现公开征求意见。如有意见和建议,请于2025年10月9日前,通过书面或电子邮件反馈。 联系人:张海;联系电话:025-83273696; 通讯地址:南京市鼓楼街5号江苏省药监局,邮政编码:210006; 电子邮箱: 397103813@qq.com。 附件: 1.长三角药品监管领域不予行政处罚清单(征求意见稿) 2.长三角药品监管领域不予行政处罚清单(征求意见稿)起草说明 江苏省药品监督管理局 2025年9月2日 (二)关于《江苏省医疗机构制剂注册与备案管理办法实施细则(征求意见稿)》公开征求意见的情况反馈 网址: http://da.jiangsu.gov.cn/art/2025/9/5/art_84644_11636077.html 2025年7月9日至8月9日,我局通过局网站发布公告,公开征求社会各界对《江苏省医疗机构制剂注册与备案管理办法实施细则(征求意见稿)》的意见。征求意见期间,我局共收到修改意见18条。经研究,我局采纳了其中6条意见。感谢社会各界对我局工作的大力支持。 江苏省药品监督管理局 2025年9月5日 三、浙江省药品监督管理局 (一)关于浙江省中药配方颗粒质量标准(第十七批)的公示 网址: https://mpa.zj.gov.cn/art/2025/9/3/art_1228989285_58942027.html 根据国家《关于结束中药配方颗粒试点工作的公告》,省局组织对蝉蜕等10个配方颗粒质量标准进行了技术审核,形成了第十七批浙江省中药配方颗粒拟公示标准。现予公示,公示期为即日起30天。在公示期内,对公示标准有意见建议,可向我局提交书面反馈意见。 联 系 人:省食品药品检验研究院 方翠芬 联系电话:0571-87180337 电子信箱: zjyjzys@zjyj.org.cn 联系地址:杭州滨江区平乐路325号 邮 编:310052 附件:1.蝉蜕配方颗粒配方颗粒质量标准(公示稿) 2.醋芫花配方颗粒质量标准(公示稿) 3.冬瓜子配方颗粒质量标准(公示稿) 4.鹤虱配方颗粒质量标准(公示稿) 5.酒乌梢蛇(浙)配方颗粒质量标准(公示稿) 6.胖大海配方颗粒质量标准(公示稿) 7.水飞蓟配方颗粒质量标准(公示稿) 8.五灵脂配方颗粒质量标准(公示稿) 9.炒黄柏配方颗粒质量标准(公示稿) 10.桑黄(段木桑黄)配方颗粒质量标准(公示稿) 浙江省药品监督管理局 2025年8月26日 四、北京市药品监督管理局 (一)新增三个共性问题 网址: https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/bjah-index-dept!detail.action?originalId=AH25082900952 五、广东省药品监督管理局 (一)对于符合条件的境外已上市药品,在国内临床阶段且未申报上市之前,是否可提出前置注册检验申请? 网址: http://mpa.gd.gov.cn/dawenku/yaopin/content/post_4766353.html 可以。根据《药品注册管理办法》《药品注册检验工作程序和技术要求规范(试行)》(2020年版)的相关要求,申请人在完成支持药品上市的药学相关研究,确定质量标准,完成商业规模生产工艺验证后,在上市申请受理之前可以提出前置注册检验。 (二)境内生产药品申请前置注册检验,申请人如何办理样品抽样? 网址: http://mpa.gd.gov.cn/dawenku/yaopin/content/post_4766352.html 根据《药品注册管理办法》《药品注册检验工作程序和技术要求规范(试行)》(2020年版)有关要求,申请人向其所在地或生产企业所在地省级药品监管部门申请抽样。 六、辽宁省药品监督管理局 网址: https://ypjg.ln.gov.cn/ypjg/gzhd/yjzj/2025090416181126566/index.shtml 为进一步优化药品现代物流标准,促进药品流通产业高质量发展,省药监局拟将《辽宁省药品现代物流指导意见(试行)》第十条第一款第一项修订为“新开办药品批发企业仓库储存区整体建筑面积应不少于2000平方米,设置与经营规模相适应的整件和零货储存区域”,现向社会公开征求意见。请于2025年10月6日前将相关意见建议反馈至电子邮箱yhltjgc.fda@ln.gov.cn,邮件主题请注明“现代物流修订意见反馈”。 特此公告。 辽宁省药品监督管理局 2025年9月4日 

特此公告。
特此公告。
2.YY/T 0809.13—2020《外科植入物 部分和全髋关节假体 第13部分:带柄股骨部件头部固定抗扭转力矩的测定》医疗器械行业标准第1号修改单
3.YY/T 1028—2023《医用内窥镜 纤维内窥镜》医疗器械行业标准第1号修改单

一、关于发布《关于药物非临床研究质量管理规范认证申请和检查相关问题的解答》的通告
网址:
2025年9月1日
2025年9月5日 
(一)辽宁省药品监督管理局关于公开征求《辽宁省药品现代物流指导意见(试行)》修订意见的公告
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容