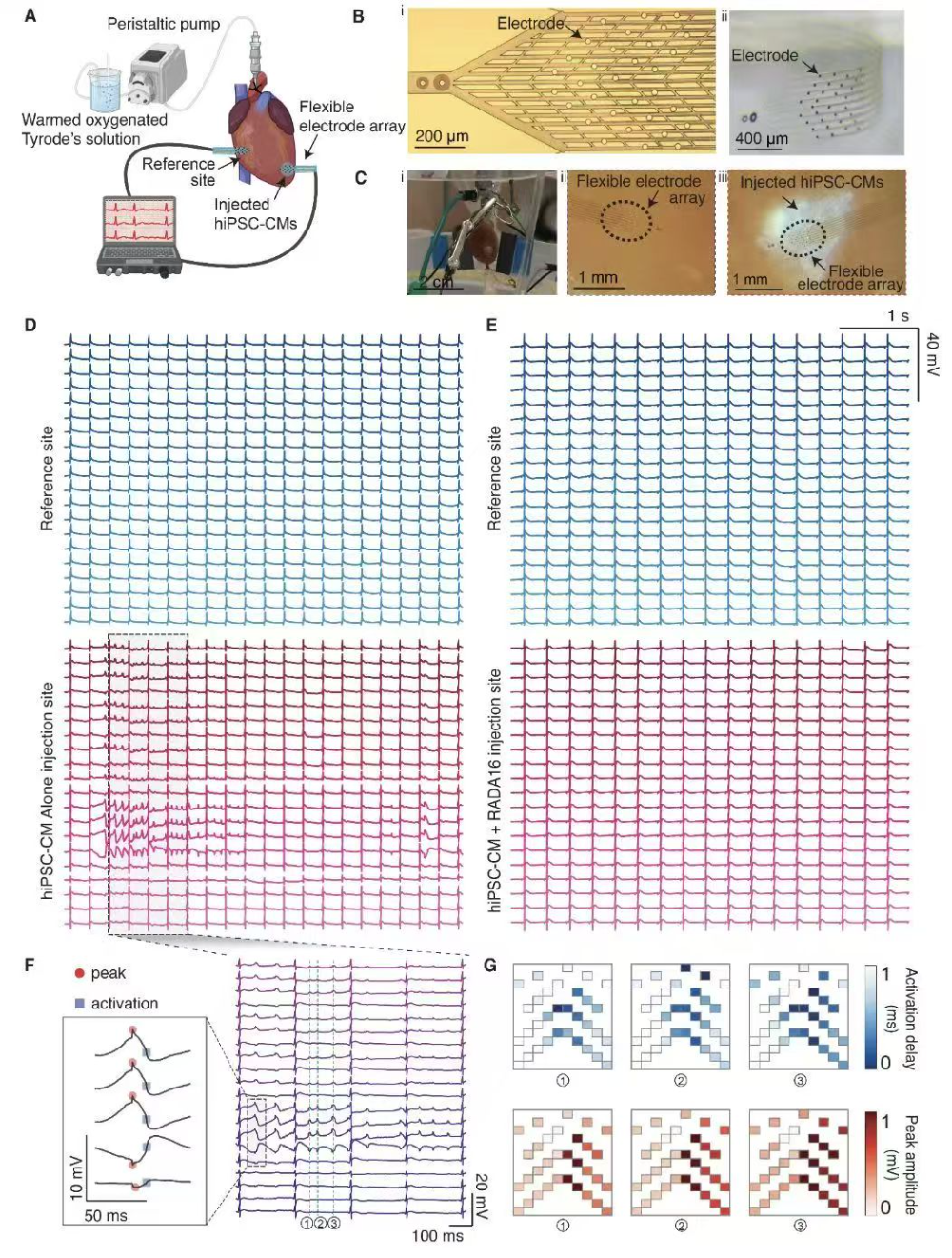
过去,要在活体组织内长期、稳定地记录细胞电活动一直是工程和生物医学领域的难题。传统的刚性电子探针与柔软的生物组织的力学不匹配,难以实现长期稳定记录。尤其是在大脑等复杂器官中,发育过程中组织形态变化剧烈,使得常规电子器件难以随组织变化保持稳定接触。哈佛大学刘嘉教授团队一直致力于开发柔软、超薄的网状纳米电子器件,以实现电子与生物组织的无缝融合。他们曾成功研制出与组织模量相匹配的“组织级柔软”网格电极,能够通过注射等微创方式植入大脑,实现单细胞级、毫秒级的长期神经信号记录,并且不引起明显的免疫反应【1】。在此基础上,刘嘉教授团队提出了一个全新的设想:利用发育过程实现电子器件的植入。因为许多三维器官都是由胚胎时期的二维细胞层折叠、生长形成的【2-5】。如果能将柔性、可拉伸的电子网片预先放置在发育中的组织中,利用组织自身的生长力量将电子网“卷入”三维结构内,就有望达到真正的“发育性植入”【5】。直接在胚胎中实验难度极高,于是研究团队将目光转向了体外的类器官(organoid)模型。类器官是由干细胞培养产生的微型器官组织,能部分模拟胚胎器官的发育过程。2019年,刘嘉教授团队在Nano Letters报道了世界首个“半机械(cyborg)类器官”【2】:他们设计出蛇形柔性网格纳米电子结构,将其转移到一层平铺的干细胞单层上,细胞凭借自身粘附力生长穿插到网格中。随着干细胞逐渐自组装成三维球状的心脏类器官,这张柔性网格也随之拉伸、变形并完全嵌入组织内部。随后研究人员将干细胞诱导分化为心肌细胞,在长期培养期内连续监测整个类器官发育过程中每个细胞电活动的变化。这是首次实现对发育中三维组织全组织范围、单细胞分辨率的功能状态映射,被誉为“半机械类器官”技术。这一创新为观察早期器官发生过程提供了前所未有的窗口,弥补了此前只能通过显微成像或基因测序静态观察发育过程的局限。正如刘嘉教授所说:“如果电子器件足够柔软灵活,能和组织一起生长,我们就能记录整个发育过程的活动”。这种嵌入式传感器技术不仅可用于回答基础发育生物学问题,还被寄予厚望用于药物筛选和移植治疗的功能评估。有了体外“半机械类器官”的成功案例,下一步的问题呼之欲出:如果将带有传感器的类器官移植到体内,它们能正常工作并与宿主组织融合吗?能否利用这种平台实时观测移植物在活体内的功能表现?刘嘉教授团队此次发表在Science杂志上发表了题为Flexible nanoelectronics reveal arrhythmogenesis in transplanted human cardiomyocytes的研究【6】。移植由人诱导多能干细胞来源的心肌细胞(hiPSC-CMs)形成的心脏组织被认为是治疗心力衰竭等疾病的潜在手段。然而,让这种心脏类器官在宿主体内存活并发挥作用并不容易。临床和动物实验中,移植的心肌细胞往往因发育未成熟或与宿主心脏缺乏电耦合而无法同步跳动,不仅贡献有限,反而可能产生异常自主节律,触发心律失常。过去,由于缺乏合适的监测手段,这些移植物在体内究竟发生了什么一直是未知的黑箱。为解决这一难题,刘嘉教授团队与哈佛医学院干细胞心血管专家Richard T. Lee教授团队合作,把柔性网格纳米电子器件应用到植入体内的人源心脏类器官中。这个柔性电子网只有微米级厚度,却具备类似细胞外基质的力学柔软性,可以紧贴在心脏组织而不引起位移。随着移植物在宿主体内存活、心脏跳动拉扯,电子网格依然能够稳定地记录移植物的电信号。研究团队建立了新的算法来分析这些信号,从中量化评估移植组织与宿主心脏的融合度。通过柔性电子的长时空监测,他们可以辨别出移植物中的细胞是否与宿主心肌细胞同步活动,还是各自为政。这种分析使得移植物的融合质量可以用数据指标来衡量,为不同移植条件和干预手段的效果比较提供了标准【6】。图1|使用柔性网状纳米电子器件在心肌组织上进行电信号记录发现:融合不良诱发心律失常,RADA16促融合改善功能这项技术带来了前所未有的发现。研究团队首次在在体环境中直接观察到:当移植的心脏类器官未能与宿主心脏实现有效电生理融合时,其内部的心肌细胞会表现出紊乱的节律活动,类似于心房颤动般的微小纤颤。这些异常自发放电现象(称为“心律失常自动性”)提示融合不良的移植物可能成为新的异位起搏灶,扰乱心脏正常的传导节律,从而增加心律失常风险。这一现象印证了刘嘉教授博士后时期对心律失常机制的预测,也是首次由实验直接证明了移植心肌组织可能引发心律失常的具体动力学原因。更令人振奋的是,借助植入式电子平台,研究者找到了改善移植物融合与功能表现的有效策略。他们对多种移植辅料和培养条件进行了筛选,最终发现:加入一种名为RADA16的自组装肽纳米纤维支架可以显著提升移植效果。RADA16是一种已获临床批准的人造多肽,注射后能快速形成纳米纤维网络。实验显示,和未处理组相比,RADA16处理后的心脏类器官在移植后成熟度大大提高:移植物内人源心肌细胞的基因表达谱更趋近成年心肌;心肌细胞中负责收缩的肌原纤维/肌节结构更加有序健全;移植部位的新生血管密度增加,供血改善。最关键的是,柔性电子检测到移植物原先存在的紊乱电活动在加入RADA16后明显减弱甚至消失——移植物细胞的异常自动放电大幅降低。换言之,RADA16促进了移植物与宿主心肌的电耦合和同步,从源头上减少了心律失常风险。该研究在心脏再生领域权威地证明了移植组织的电生理融合度对治疗安全性和效果至关重要,并提供了一种实时评估融合度的方法。通过这一“电子-生物”平台,研究人员系统比较了不同移植条件下的效果,为优化心肌再生治疗提供了宝贵数据。例如,在植入前加入RADA16等基质材料,或改进细胞培养流程以提高类器官的成熟度,都有望加速移植物功能化,减少不良心律的发生。这些结果不仅对心脏类器官移植具有指导意义,也为其他类型的组织工程移植(如神经类器官、大脑类器官移植等)提供了思路:植入式柔性电子有望作为普适的监测工具,及时发现和纠正移植物功能异常,提高再生医学疗法的安全性。刘嘉教授团队的这系列研究表明,柔性电子技术与干细胞类器官的融合将成为再生医学研究的强大工具。从2019年嵌入心脏类器官的初步探索【2】、到2023年发展出结合空间基因测序与电生理记录的原位电测序技术,实现同一细胞的基因表达与电功能同步描绘【3】,再到2025年在活体中监测移植类器官并干预其成熟融合,这一路径展示了从体外到体内的逐步跨越【6】。今年6月,刘嘉教授团队还在Nature发表成果,将同类柔性网格电极成功植入非洲爪蟾胚胎的大脑中,创造了“半机械胚胎”和“电子蝌蚪”,实现了从胚胎期开始的全脑神经活动长期记录【5】。这证明即使在复杂活体发育体系中,柔性电子依然能够伴随组织生长而深度整合,为研究神经发育和再生提供了革命性手段。如今发表于Science的这项心脏类器官研究,将“半机械”概念进一步推向临床应用的前沿。柔性网状纳米电子为评估移植细胞疗法的功能提供了前所未有的实时窗口:我们不仅能看到移植物长得怎样,还能“听到”它如何跳动。同样重要的是,这一平台还能作为安全监控系统,及时发现潜在的心律失常等风险,并可用于筛选最佳的移植优化方案。研究结果表明,利用自组装纳米纤维支架等辅助手段可以显著提高心肌类器官移植的成功率和安全性【6】。从更广阔的角度来看,“电子-类器官”融合技术为未来个性化医疗和组织工程带来了新希望——或许有一天,我们可以为每位患者打造带有智能传感器的“器官补丁”,植入后不仅能治疗疾病,还能实时反馈康复过程中的功能指标,确保疗法安全有效。据悉,该研究由哈佛大学工程与应用科学学院刘嘉教授实验室牵头,Junya Aoyama博士、刘韧博士、张馨鹤为共同第一作者,哈佛医学院Lee教授团队参与合作。刘嘉教授表示,这项研究得到了多学科合作的支持,凝聚了团队多年在柔性电子、生物工程和干细胞技术交叉领域的探索成果。柔性电子+类器官的“半机械生物”平台有望成为再生医学领域评价疗法安全性和有效性的核心支撑技术,为组织工程和细胞治疗从实验室走向临床保驾护航。未来,随着电子器件集成度和功能的提升,研究团队计划进一步尝试记录更多类型细胞的活动,并加入智能算法实现对移植物的反馈调控,让“半机械器官”不但能感知自身状态,还能主动干预促进更完善的组织融合和功能恢复。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容