
2025-12-30 11:11:17来源:注册圈浏览量:819
https://www.cde.org.cn/main/news/viewInfoCommon/a9bd3c14d8da67cbafa56aab92df9253

依据《儿童抗肿瘤药物研发鼓励试点计划(星光计划)申报指南》,现将甲磺酸瑞索利塞(CYH33)纳入“星光计划”,试点项目的基本信息如下:
品种名称:甲磺酸瑞索利塞(CYH33)
申报单位:上海海和药物研究开发股份有限公司
拟开发儿童适应症:具有严重临床表现、需要系统治疗的PIK3CA相关过度生长谱(PROS)和PIK3CA相关脉管畸形(PRVM)
国家药品监督管理局药品审评中心
2025年12月25日
二、关于公开征求ICH《M8:电子通用技术文档(eCTD)》指导原则相关文件中文翻译稿意见的通知
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/f3bf670a7dcbf4bb045f5927fbe7fe72

为进一步推进ICH 《M8:电子通用技术文档(eCTD)》(以下简称M8)指导原则在国内落地实施,我中心拟定了M8指导原则相关文件中文翻译稿,现公开征求意见,为期1个月。如有修改意见,请反馈至联系人电子邮箱:gkzhqyj@cde.org.cn。
附件:1.ICH eCTD技术规范V3.2.2中文翻译稿
2.ICH研究标签文件的eCTD骨架文件技术规范V2.6.1中文翻译稿
3.ICH eCTD文件格式规范V1.3中文翻译稿
4.ICH eCTD IWG问题解答和规范变更要求文件V1.33中文翻译稿
5.ICH eCTD技术规范V3.2.2英文稿
6.ICH研究标签文件的eCTD骨架文件技术规范V2.6.1英文稿
7.ICH eCTD文件格式规范V1.3英文稿
8.ICH eCTD IWG问题解答和规范变更要求文件V1.33英文稿
国家药品监督管理局药品审评中心
2025年12月25日

三、药审中心举办2025年第十二期“药审云课堂”及下期预告
网址:
https://www.cde.org.cn/main/newspic/view/39f7ccce9835e168e57c4e1953b94fbd


2025年12月5日,药审中心举办2025年第十二期“药审云课堂”。本期云课堂由药审中心主办,京津冀分中心承办,以药品研发关键技术为专题,通过线上线下相结合的方式开展,吸引了来自药品监管机构、药物研发企业、临床研究机构等行业人员近万人在线观看。药审中心副主任杨志敏为本期云课堂作开场致辞。
本期云课堂由药审中心选派的5名经验丰富的审评员进行授课。在《创新药注册申请沟通交流及受理常见问题》讲解中,讲者从创新药注册申请沟通交流常见问题和受理常见问题两方面,分享了申报资料要求及相关表格填写注意事项等要点。在《治疗用生物制品关键问题考虑》讲解中,讲者从首次药物临床试验申请药学资料撰写、制造及检定规程撰写以及生物制品分段生产技术要求等方面,详细解析了其中关键点。在《先进治疗药品临床审评中常见问题及相关考虑》讲解中,讲者通过图文结合,深入讲解了先进治疗药品及其特点、先进治疗药品临床审评常见问题和考虑。在《生物制品上市后药学变更研究的考虑及案例分析》讲解中,讲者结合案例分析,从变更概述、变更风险评估及管理工具、变更研究等方面展开讲解。在《纳米药物审评相关要求》讲解中,讲者从纳米药物监管科学研究、纳米药物审评相关要求两方面展开,分享了纳米药物新技术、质量控制、非临床研究等内容,以期为企业生产研发提供助力。
培训期间设置了线上与线下答疑环节,讲者与参会人员围绕实际研发与审评中遇到的问题进行了深入交流。
截至目前,“药审云课堂”平台已累计上传视频164个,形成了覆盖各专业领域的课程体系,如沟通交流要点、受理资料要求、审评全流程讲解、审评中关键技术问题(如变更、药学研究、临床研究)等方面,均有较为全面的课程。近期药审云课堂平台新上传视频列表如下,请及时观看学习。
1.创新药注册申请沟通交流及受理常见问题
2.治疗用生物制品关键问题考虑
3.先进治疗药品临床审评中常见问题及相关考虑
4.生物制品上市后变更研究的考虑及案例分析
5.纳米药物审评相关要求
【下期预告】为提升培训质量与实效,2026年拟对药审云课堂进行全面升级,增加“线上+线下”举办形式,每期培训通知将通过药审中心网站不定期发布。2026年首场培训拟于1月底启动报名,计划对相关ICH指导原则监管理念开展宣贯,请有意参与者及时关注报名通知。
https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypshmshxdgg/20251222114033197.html

根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对孟鲁司特制剂(包括孟鲁司特钠片、孟鲁司特钠咀嚼片、孟鲁司特钠颗粒和孟鲁司特钠口溶膜)说明书内容进行统一修订。现将有关事项公告如下:
一、所有上述药品的上市许可持有人均应当依据《药品注册管理办法》等有关规定,按照附件要求修订说明书,于2026年3月12日前报国家药监局药品审评中心或省级药品监督管理部门备案。
修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换或以其他形式将说明书更新信息告知患者。
二、药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师合理用药。
三、临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。
四、患者用药前应当仔细阅读药品说明书,使用处方药的,应当严格遵医嘱用药。
五、省级药品监督管理部门应当督促行政区域内上述药品的上市许可持有人按要求做好相应说明书修订和标签、说明书更换及说明书更新信息的告知工作,对违法违规行为依法严厉查处。
特此公告。
附件:孟鲁司特制剂说明书修订建议
国家药监局
2025年12月12日
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20251222182516159.html

为了规范互联网药品医疗器械信息服务备案,加强互联网药品医疗器械信息服务管理,依据《互联网信息服务管理办法》,国家药监局制定了《互联网药品医疗器械信息服务备案管理规定》,现予发布,自发布之日起施行。
特此公告。
附件:互联网药品医疗器械信息服务备案管理规定
国家药监局
2025年12月19日
https://www.nmpa.gov.cn/xxgk/ggtg/hzhpggtg/jmhzhptg/20251223114130129.html

为规范牙膏行业发展,助企减负增效,根据《化妆品监督管理条例》《牙膏监督管理办法》等规定,现就牙膏备案管理有关事项公告如下:
国家药监局《关于贯彻落实牙膏监管法规和简化已上市牙膏备案资料要求等有关事宜的公告》(2023年第124号)规定,简化备案的牙膏产品,牙膏备案人应当于2025年12月1日前,按照相关法规规定要求,整理完成相应的产品备案资料。
经组织专家研究,鉴于实施简化备案的牙膏产品具有一定的生产、销售和使用历史,牙膏备案人在整理产品备案资料时,可以通过产品安全使用历史的证明性资料替代毒理学试验报告。
首批产品上市销售日期在2021年1月1日之后的,备案人在补充提交备案资料时,可以在提交符合要求的产品安全评估报告的基础上,对产品生产销售情况、是否发生质量安全事件及不良反应监测情况进行说明,证明产品具有安全使用历史,免于提交口腔黏膜刺激试验报告。
特此公告。
国家药监局
2025年12月22日
https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20251224111804135.html
为持续推动药品注册技术标准与国际接轨,经研究,国家药品监督管理局决定适用《E6(R3):药物临床试验质量管理规范技术指导原则》国际人用药品注册技术协调会指导原则(以下简称E6(R3)指导原则)。现就有关事项公告如下:
一、自2026年3月31日后实施的药物临床试验,均适用E6(R3)指导原则。
二、相关技术指导原则可在国家药品监督管理局药品审评中心网站查询。国家药品监督管理局药品审评中心负责做好本公告实施过程中的相关技术指导工作。
特此公告。
国家药监局
2025年12月22日
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20251225100838171.html
为支持医疗器械出口贸易,规范药品监督管理部门出具医疗器械出口销售证明的服务性事项办理,国家药监局修订发布《医疗器械出口销售证明管理规定》,该规定自2026年5月1日起施行,原国家食品药品监督管理总局《关于发布医疗器械产品出口销售证明管理规定的通告》(2015年第18号)同时废止。
特此公告。
附件:医疗器械出口销售证明管理规定
国家药监局
2025年12月24日
https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20251226103452162.html


https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20251226144547189.html

为落实《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号),根据《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号),按照《国家药监局关于发布优化全生命周期监管支持高端医疗器械创新发展有关举措的公告》(2025年第63号)要求,国家药监局组织制订了《优先审批高端医疗器械目录(2025版)》(以下简称《目录》),现予公布,并就有关事宜通告如下:
一、国家药监局对《目录》中的医疗器械注册申请按照《医疗器械注册与备案管理办法》第七十三条第(三)项情形实施优先审批。
二、国家药监局医疗器械技术审评中心按程序对《目录》产品注册申请材料进行审核。审核拟定予以优先审批的,公示审核结果无异议后进入优先审批程序;审核拟定不予优先审批的,告知注册申请人原因并按常规程序办理。
三、本《目录》自公布之日起施行。后续国家药监局将根据需要进行调整。
特此通告。
国家药监局
2025年12月24日
网址:
https://www.cfdi.org.cn/cfdi/resource/news/16622.html
进一步提升生物等效性试验电子化记录的规范性,更好地满足《药物临床试验质量管理规范》和监管部门相应技术指南的原则要求,核查中心与信息中心组织制定了《生物等效性试验电子化记录技术指南(试行)》(见附件)。经国家药品监督管理局同意,现予发布,自发布之日起施行。
特此通告。
附件:生物等效性试验电子化记录技术指南(试行).pdf
国家药品监督管理局 国家药品监督管理局
食品药品审核查验中心 信息中心
2025年12月22日
二、关于提醒填报2025年度药物和医疗器械临床试验机构年度工作总结报告的通知
网址:
https://www.cfdi.org.cn/cfdi/resource/news/16629.html
根据《药物临床试验机构管理规定》《医疗器械临床试验机构条件和备案管理办法》相关规定,机构应当在“药物和医疗器械临床试验机构备案管理信息系统”提交上一年度开展药物和医疗器械临床试验工作的总结报告。现对2025年度临床试验工作总结报告填报的注意事项提醒如下:
1.请各机构按照《药物临床试验机构年度工作总结报告填报指南》《医疗器械临床试验机构年度工作总结报告填报指南》的要求,于2026年1月31日前在线填报2025年度开展临床试验工作的总结报告。
2.为满足强化临床试验机构监督管理工作的需要,请各机构在系统中同步完善主要研究者的身份信息。
特此通知。
http://da.jiangsu.gov.cn/art/2025/12/23/art_84627_11698651.html
为贯彻落实省政府关于推动医药产业高质量发展的部署要求,根据《江苏省药品监督管理局审评核查分中心考核与赋权实施办法(试行)》,现决定自2025年12月23日起向江苏省药品监督管理局审评核查扬州分中心赋权审评事项12项、核查事项26项(详见附件)。
特此公告。
附件:江苏省药品监督管理局审评核查扬州分中心增项赋权事项清单.pdf
江苏省药品监督管理局
2025年12月23日
网址:
https://mpa.zj.gov.cn/art/2025/12/23/art_1228989285_58943138.html
根据《国家药监局 国家中医药局 国家卫生健康委 国家医保局关于结束中药配方颗粒试点工作的公告》(2021年第22号),浙江省药品监督管理局审核通过了蝉蜕等9个配方颗粒质量标准,现予以发布。除本标准另有规定外,有关农药残留、重金属及有害元素、真菌毒素及二氧化硫残留等仍参照现行版《中国药典》中药饮片的规定执行。
蝉蜕等9个配方颗粒质量标准自发布之日起施行。施行中遇到的问题,请及时反馈我局。
特此通告。
附件:1.蝉蜕配方颗粒质量标准(浙PF20250012)
2.醋芫花配方颗粒质量标准(浙PF20250013)
3.冬瓜子配方颗粒质量标准(浙PF20250014)
4.鹤虱配方颗粒质量标准(浙PF20250015)
5.胖大海配方颗粒质量标准(浙PF20250016)
6.水飞蓟配方颗粒质量标准(浙PF20250017)
7.五灵脂配方颗粒质量标准(浙PF20250018)
8.炒黄柏配方颗粒质量标准(浙PF20250019)
9.桑黄(段木桑黄)配方颗粒质量标准(浙PF20250020)
浙江省药品监督管理局
2025年12月22日
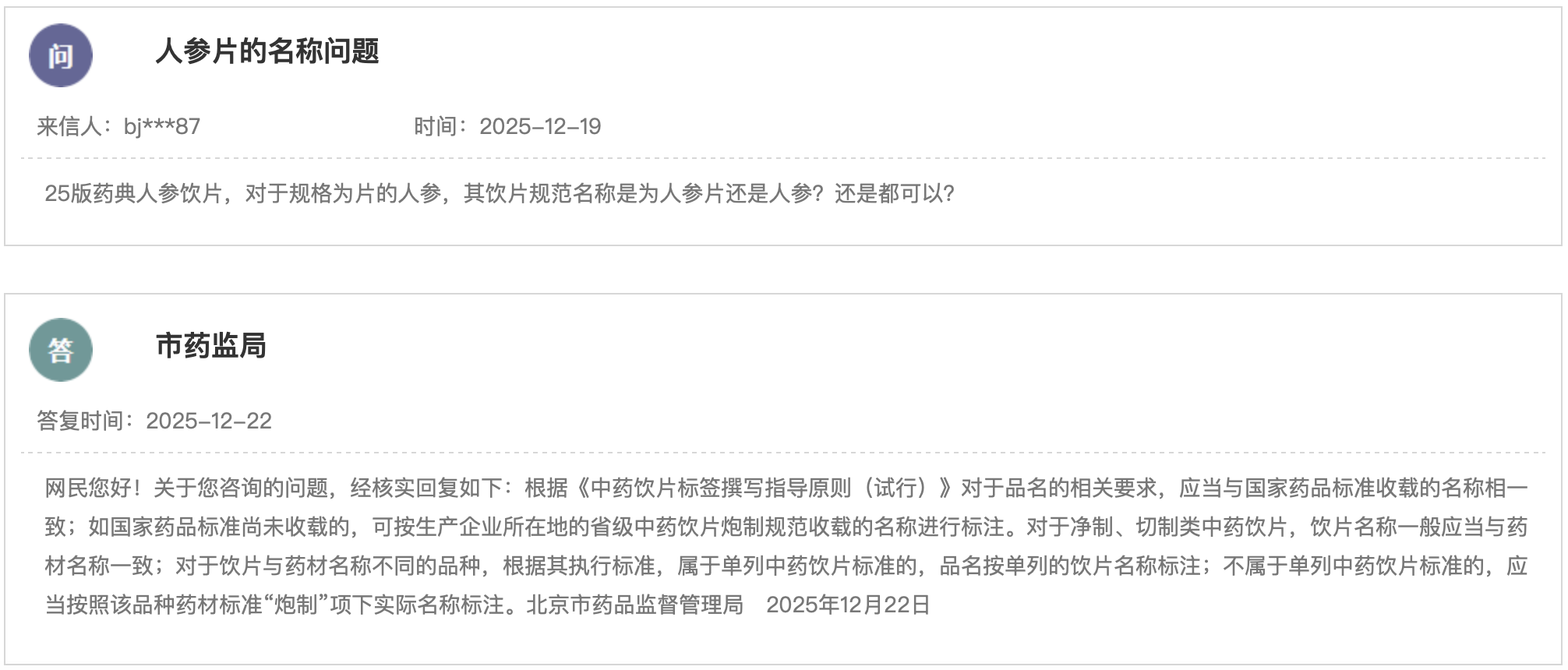
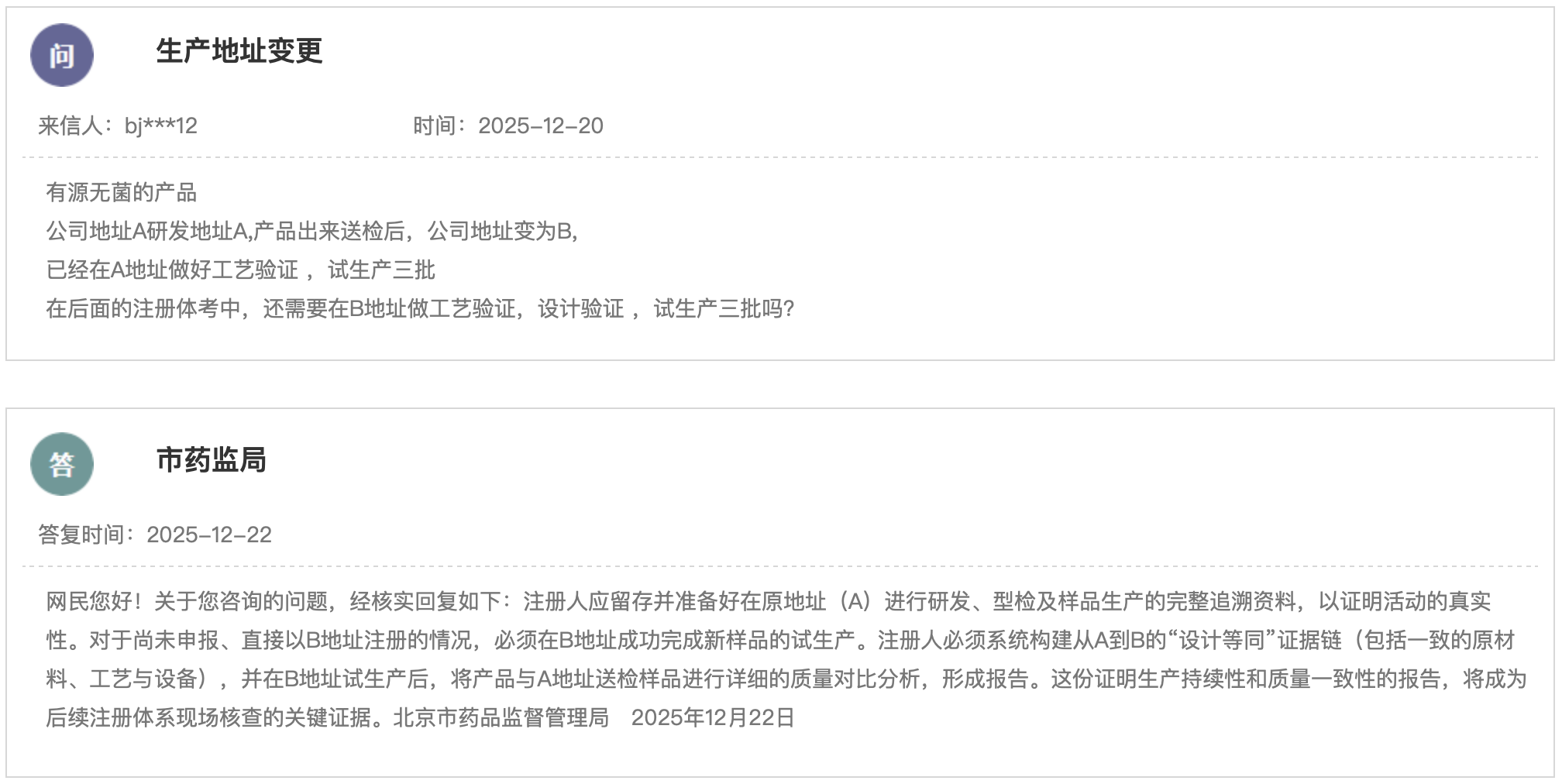
(一)新增3个共性问题
网址:
https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/xx-yjj.html

(一)广东省卫生健康委员会 广东省药品监督管理局关于印发粤港澳大湾区“港澳药械通”第四批指定医疗机构名单的通知
网址:
http://mpa.gd.gov.cn/zwgk/gzwj/content/post_4835545.html
广州、深圳、珠海、佛山、惠州、东莞、中山、江门、肇庆市卫生健康局(委)、市场监管局,横琴粤澳深度合作区民生事务局、商事服务局:
根据国家《粤港澳大湾区药品医疗器械监管创新发展工作方案》(国市监药〔2020〕159号)和推进“港澳药械通”实施计划,依据相关法规规定,通过地市评估上报,经审核确定粤港澳大湾区“港澳药械通”第四批指定医疗机构名单,包括新增27家、移出1家(详见附件)。
各有关地级以上市卫生健康、市场监管行政主管部门要加强对指定医疗机构的指导管理,着重对临床急需进口使用港澳药械的医疗水平、保管条件、组织制度、应急处置和风险防范等方面进行检查,发现问题及时处理并上报省级主管部门。要加大推进各指定医疗机构开展港澳药械申报进口使用工作力度,主动协调优化医保赋码、支付等项目事项。帮助医疗保险延伸至“港澳药械通”医疗服务,促进大湾区医疗融合高质量发展。
各指定医疗机构要认真学习遵守《广东省粤港澳大湾区内地九市进口港澳药品医疗器械管理条例》及“港澳药械通”工作机制,切实履行主体责任,建立院领导牵头负责制度,不断深化与港澳医疗卫生服务合作,加强临床需求研究,优化院内流程,支持“绿色通道”,积极向省级药品监督部门平台申报港澳药械产品材料,健全港澳药械提报、采购、使用、贮存、配送和风险防范等制度,落实法定代表人承诺制度,实现来源可溯、去向可追、风险可控、责任可究,确保进口港澳药械仅用于本医疗机构特定医疗目的,严禁非法流入社会,保障用药用械安全,切实让广大人民群众享受到更加优质、高效、安全的医疗服务。
附件:“港澳药械通”第四批指定医疗机构名单
广东省卫生健康委员会 广东省药品监督管理局
2025年12月5日