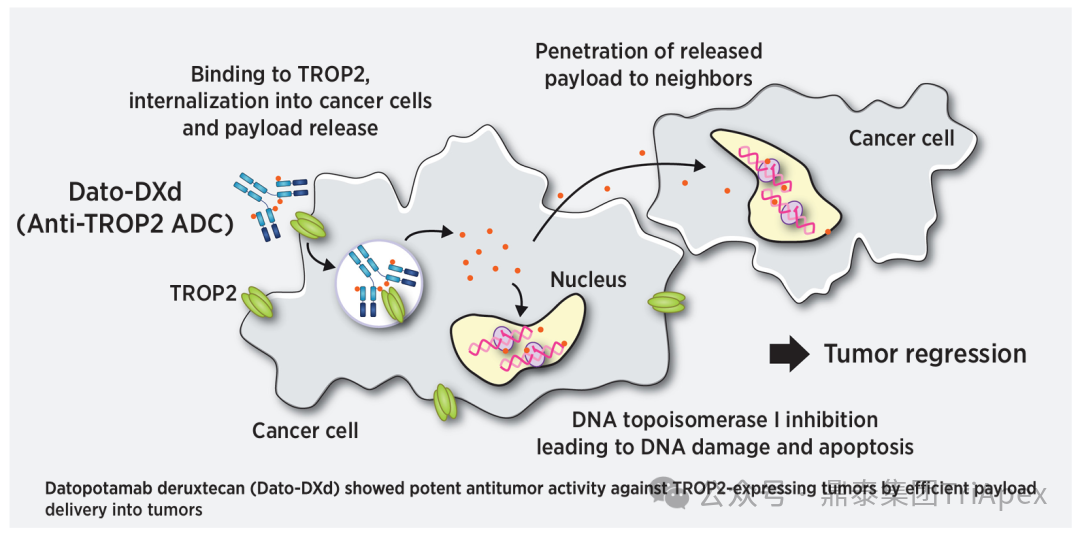
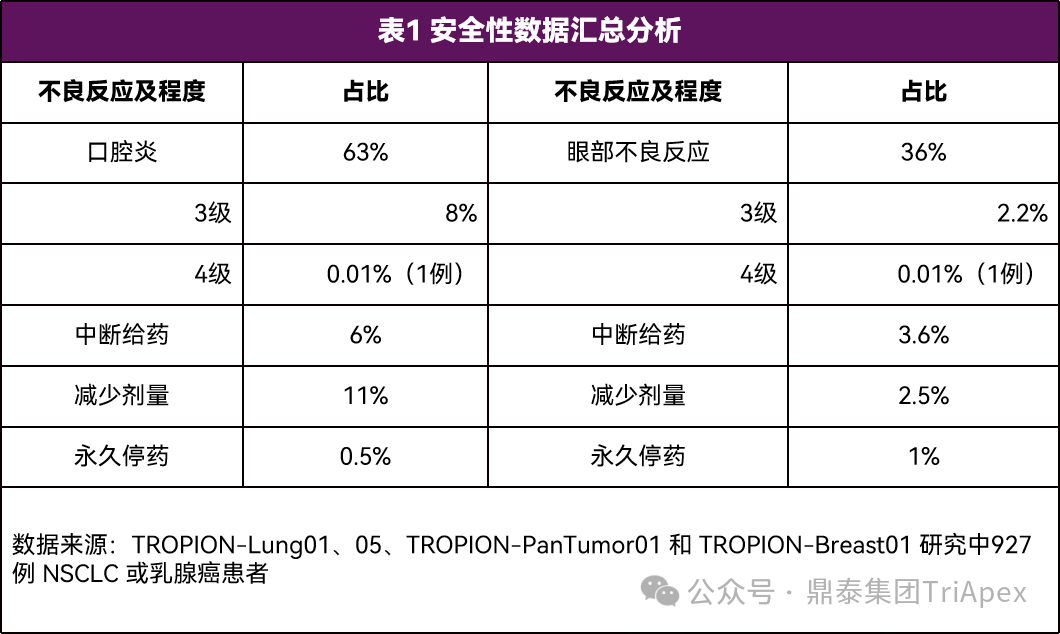
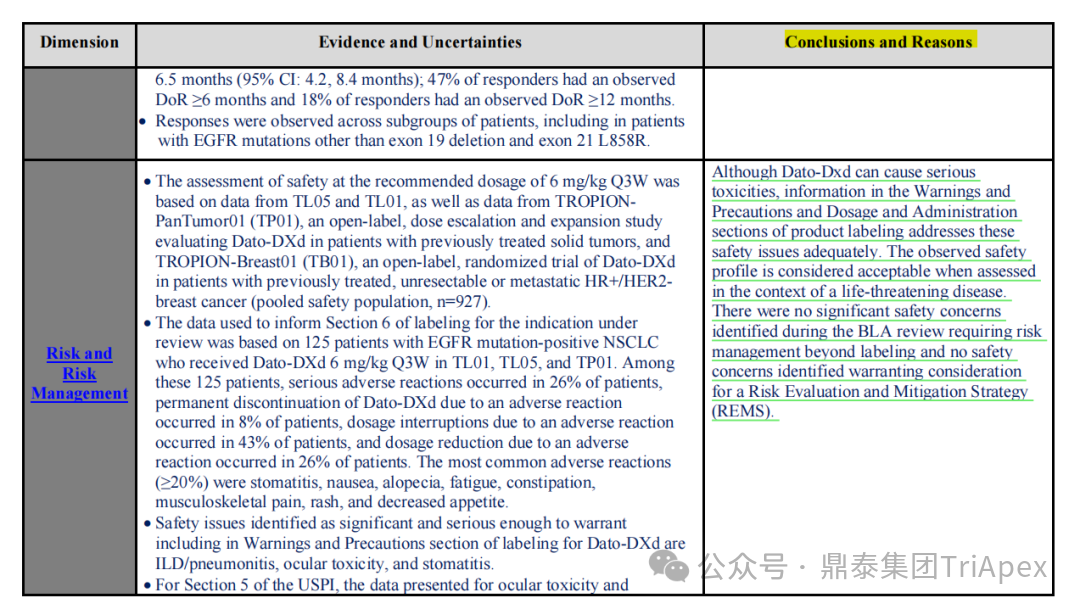
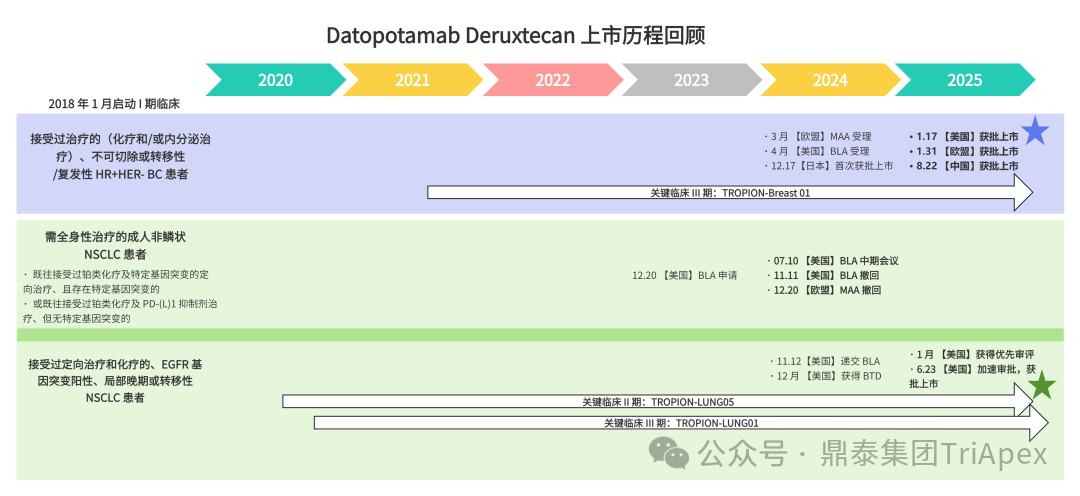
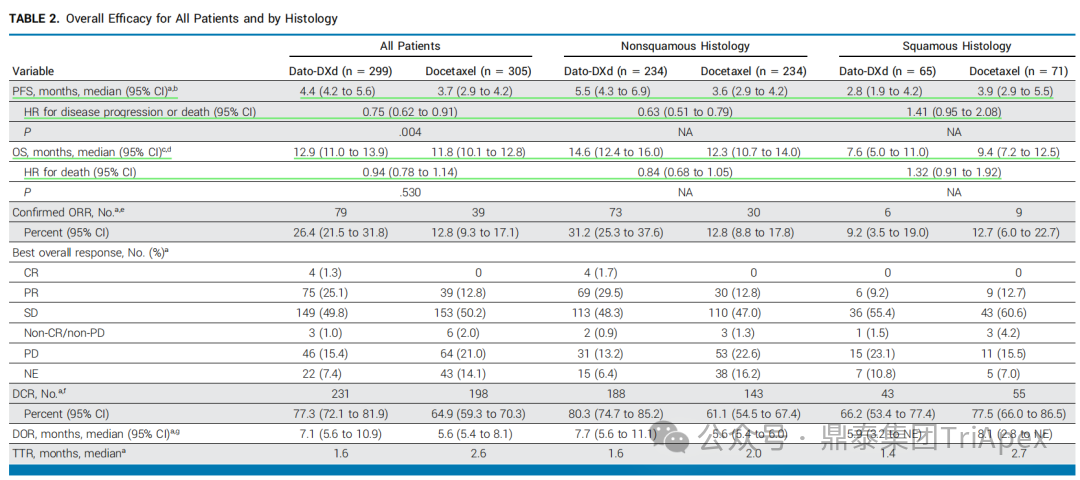
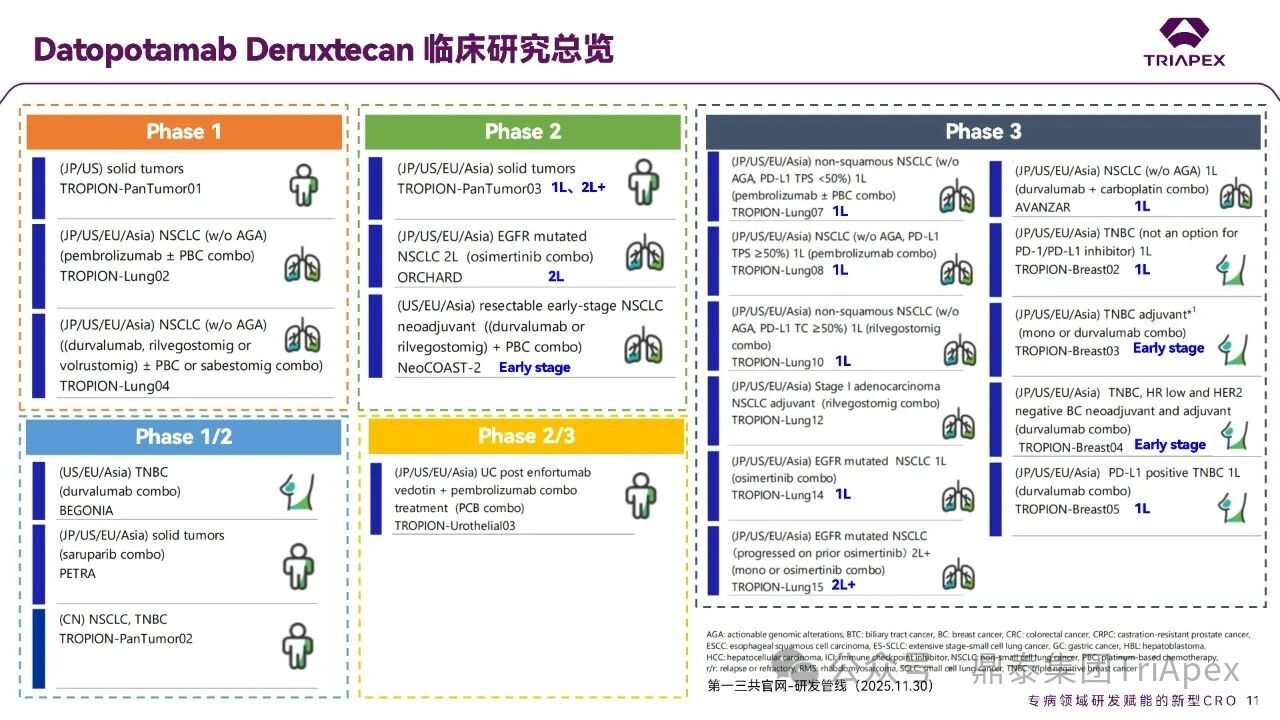
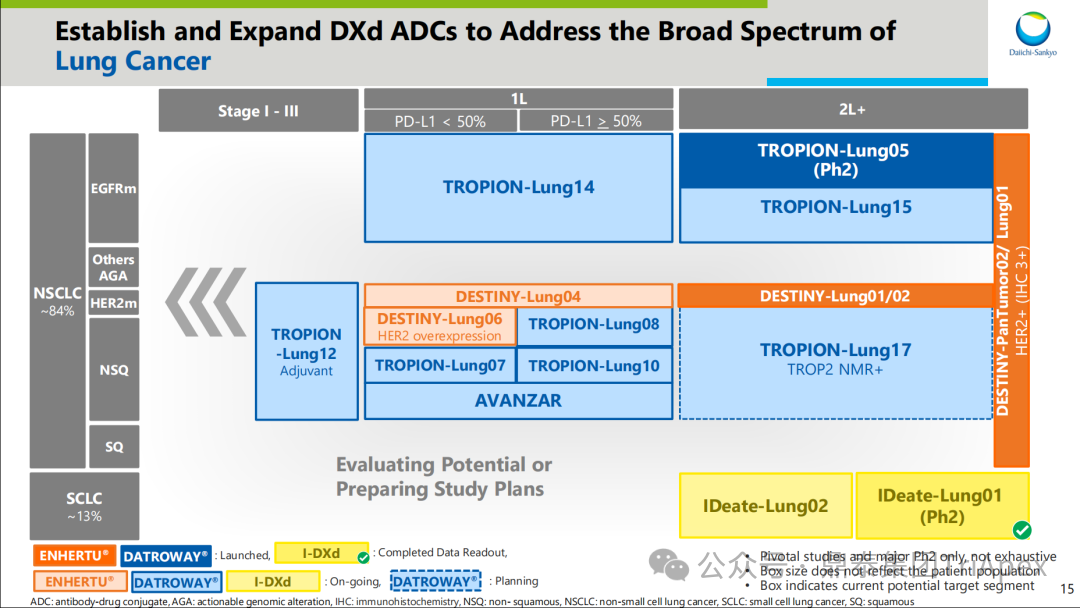
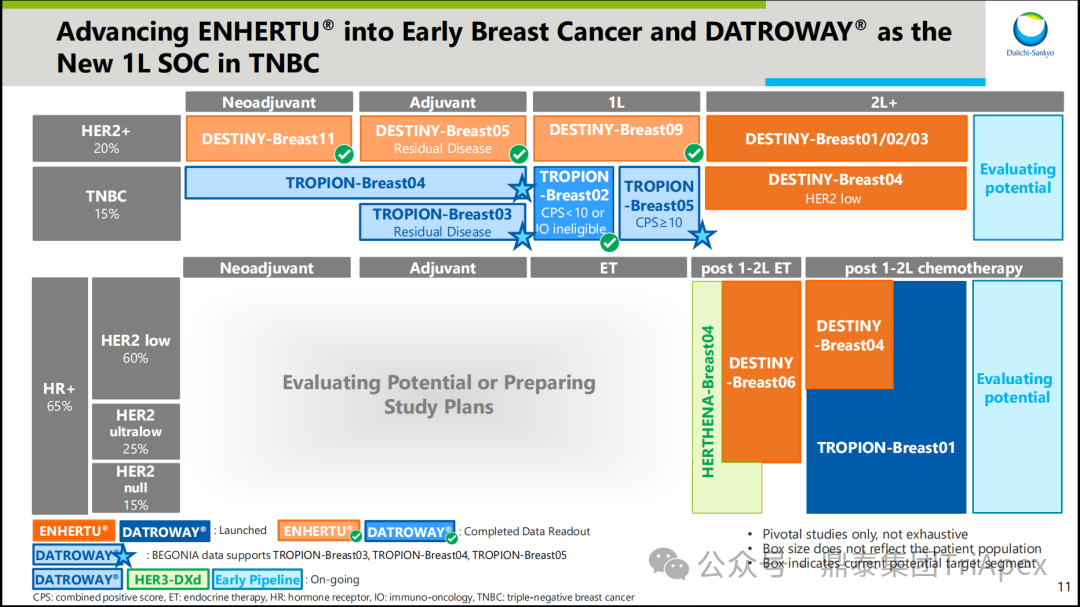
2026-01-05 14:07:44来源:鼎泰集团TriApex浏览量:354
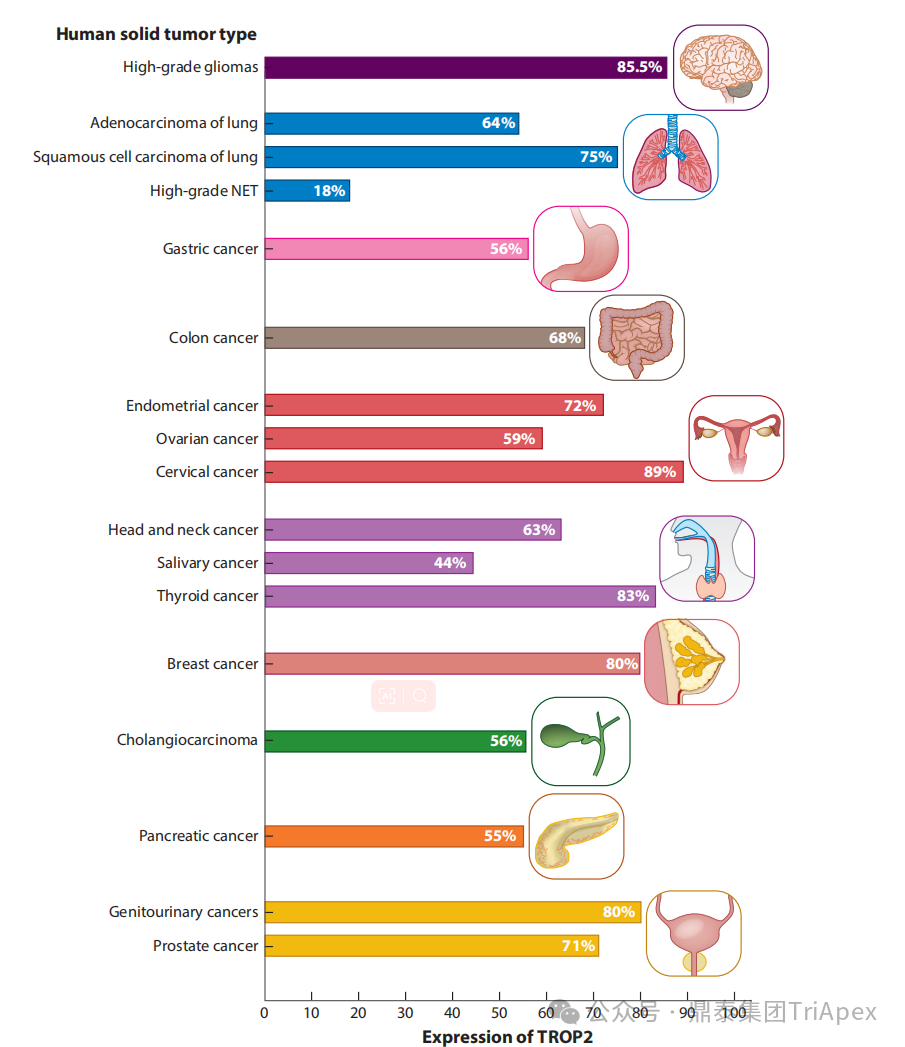
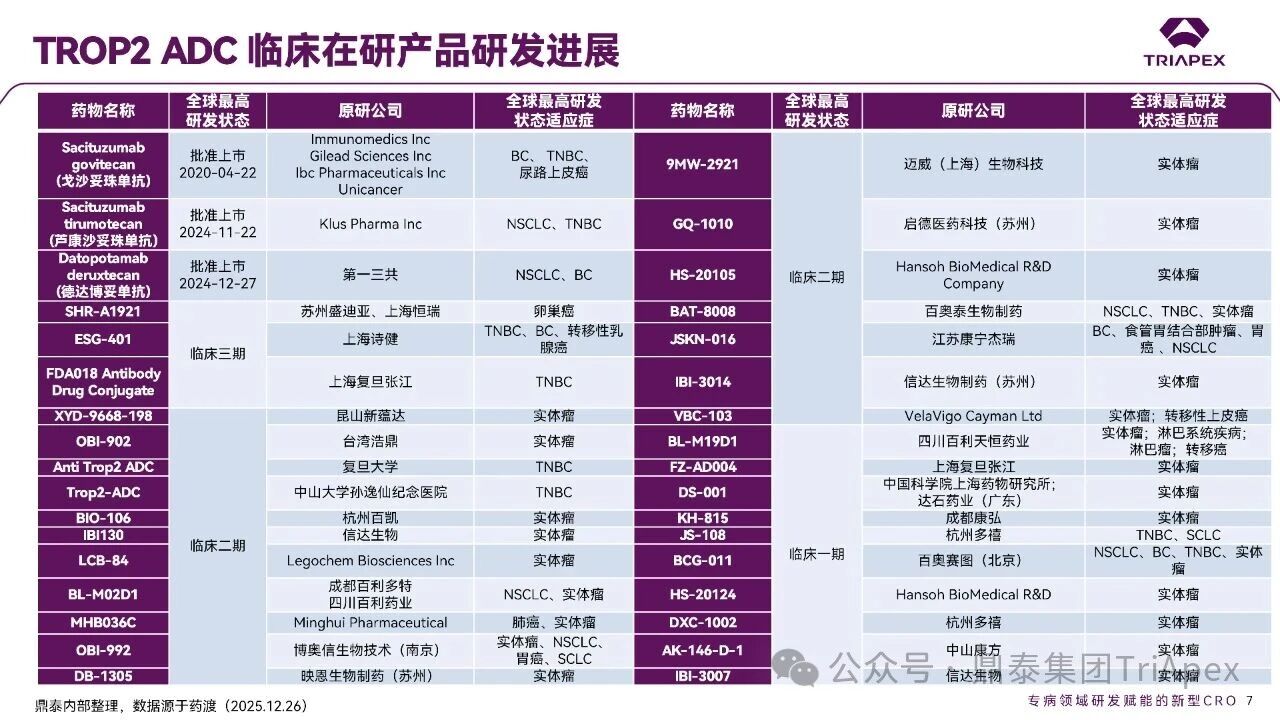
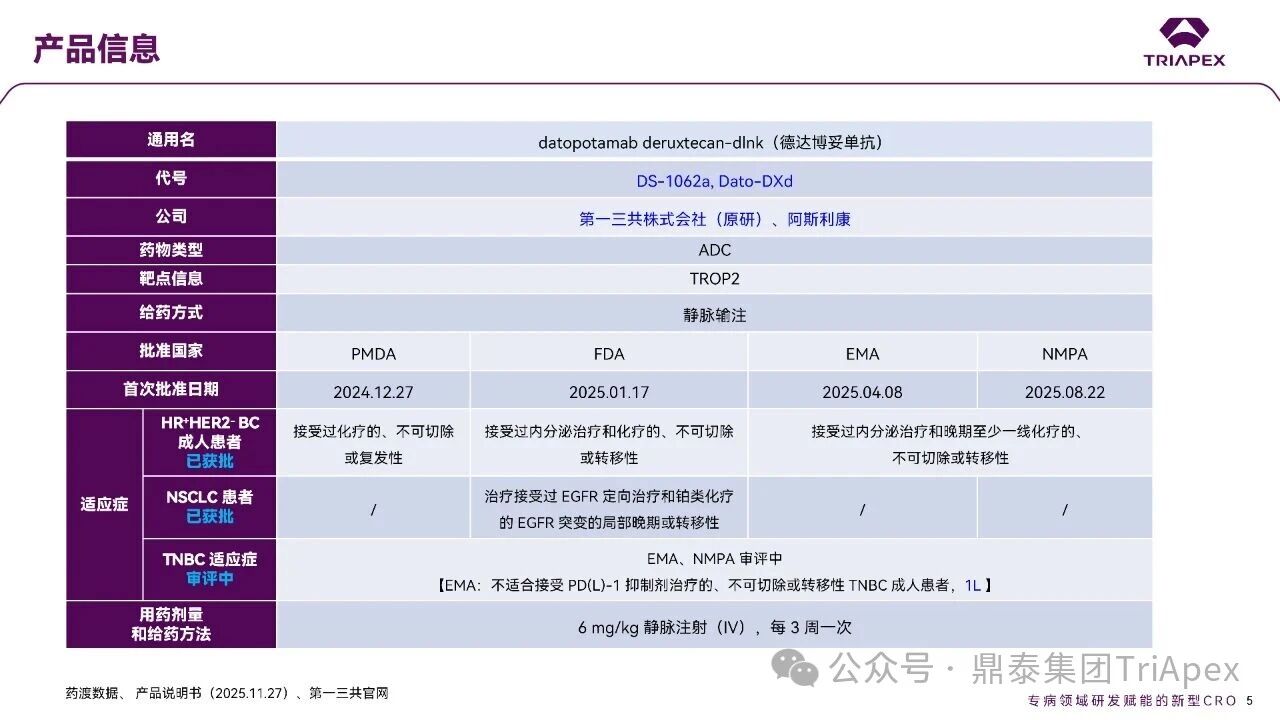
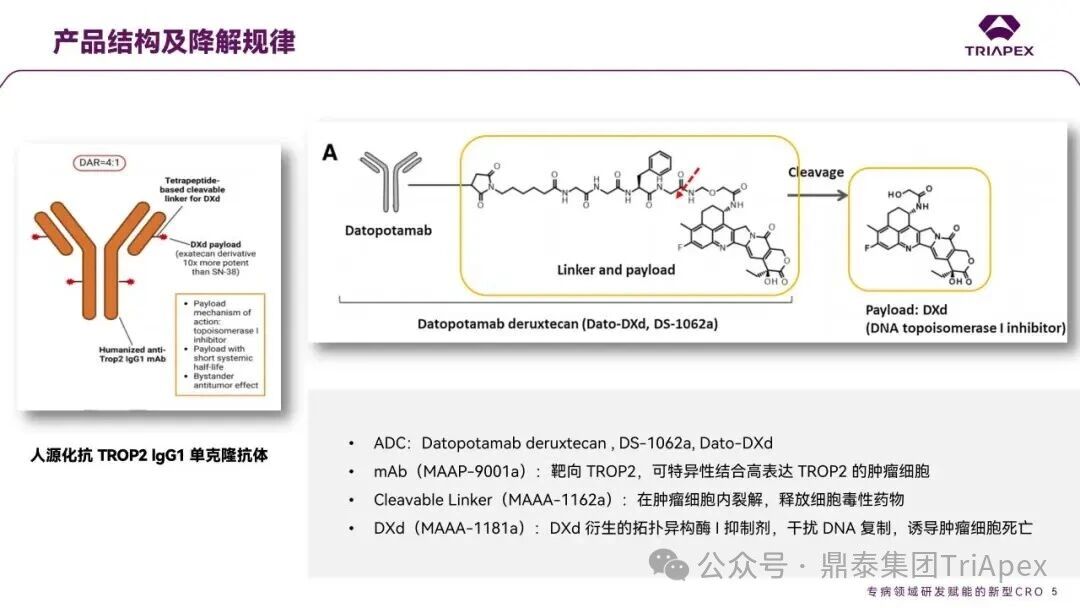
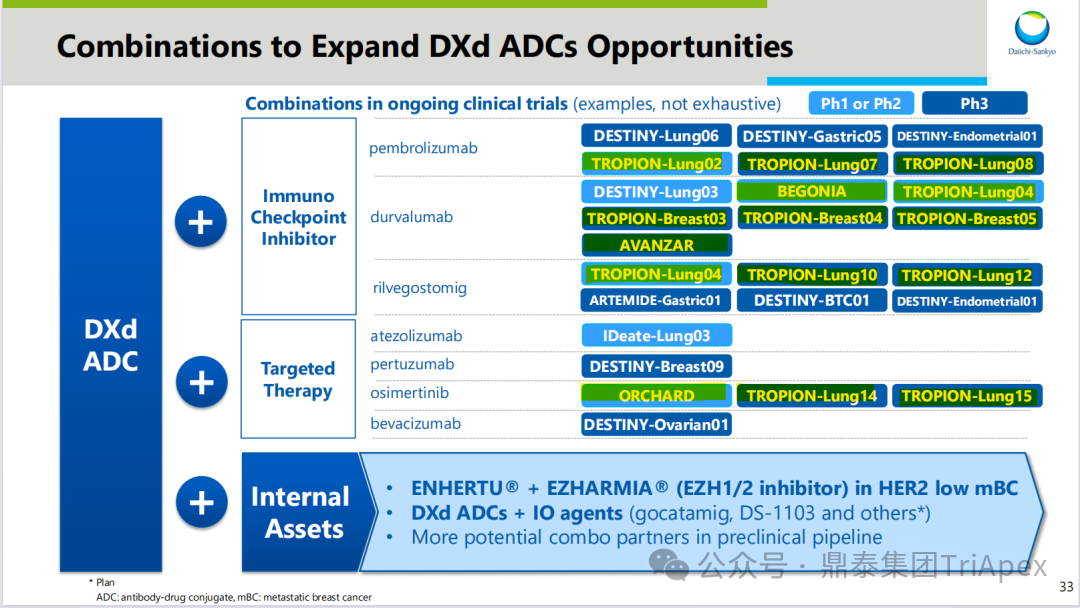
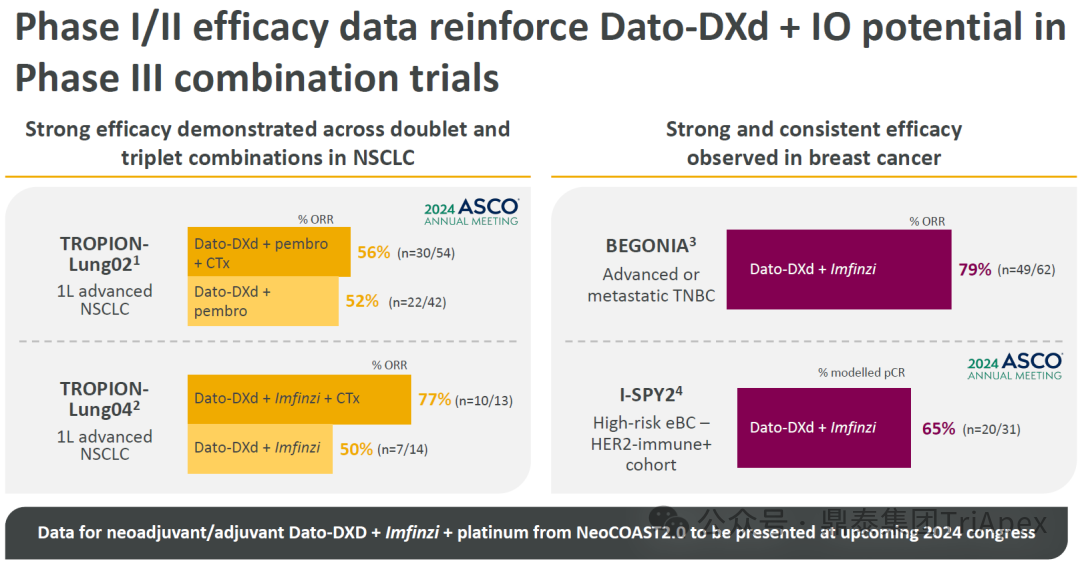
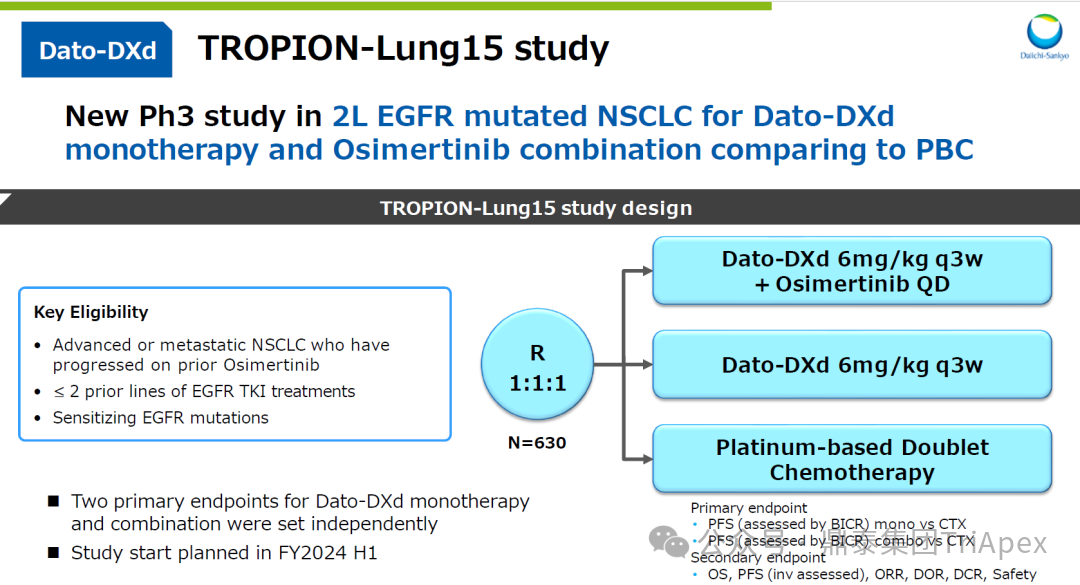
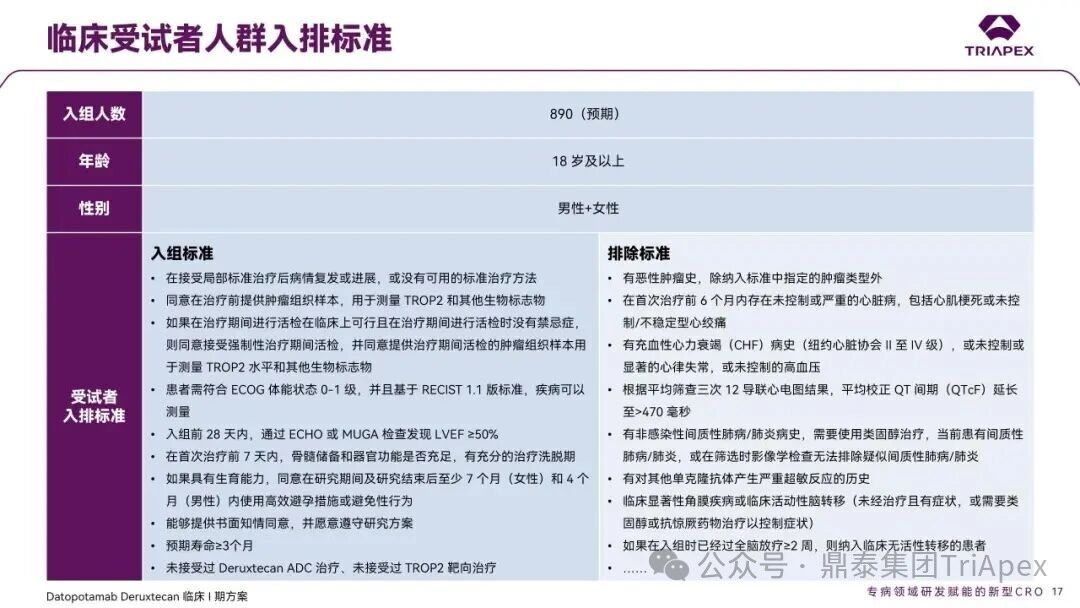
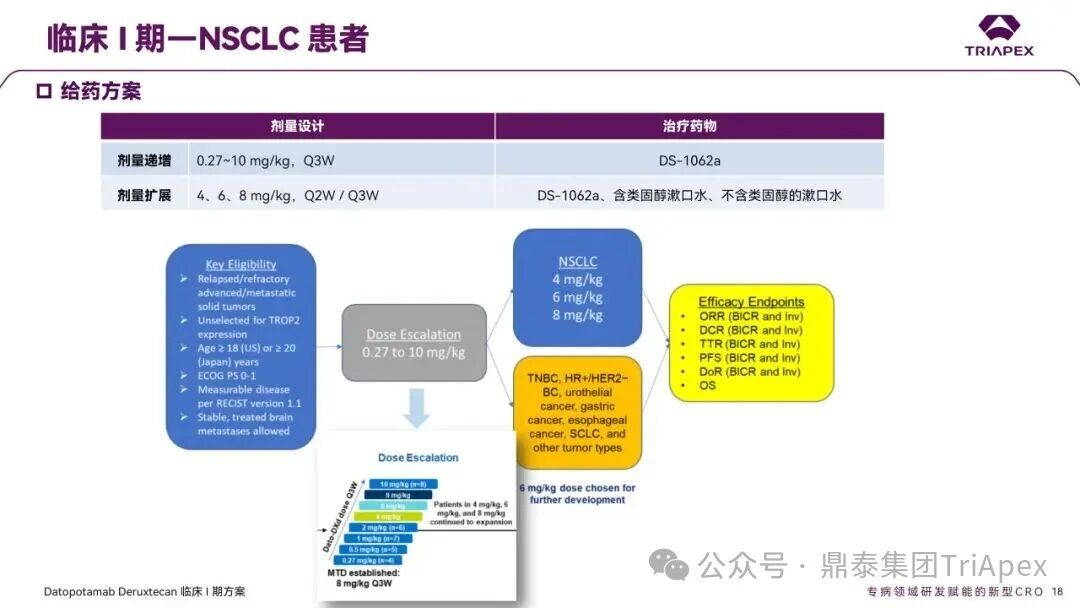
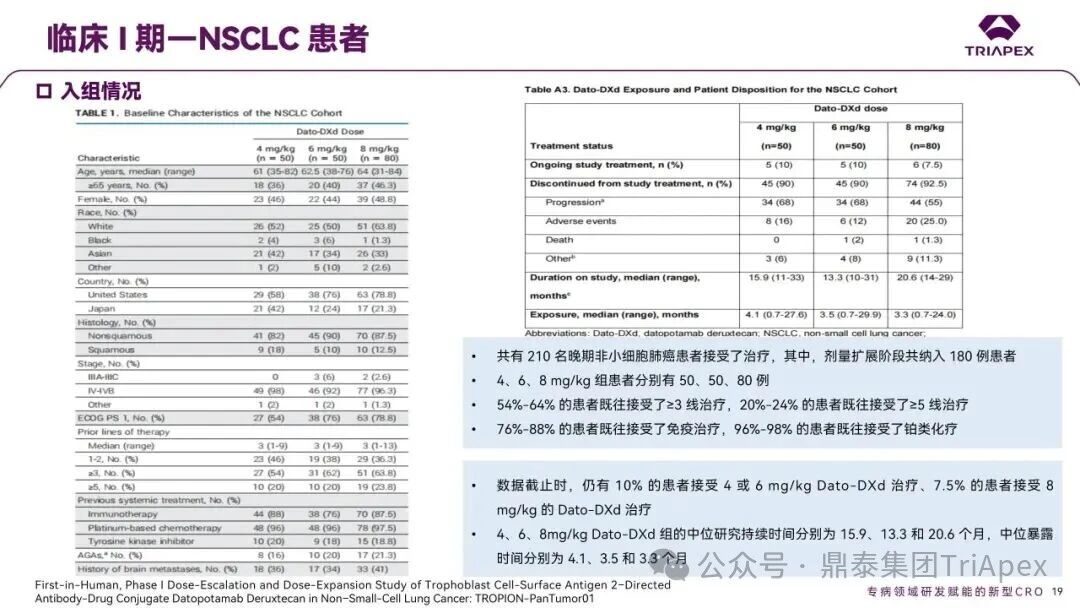
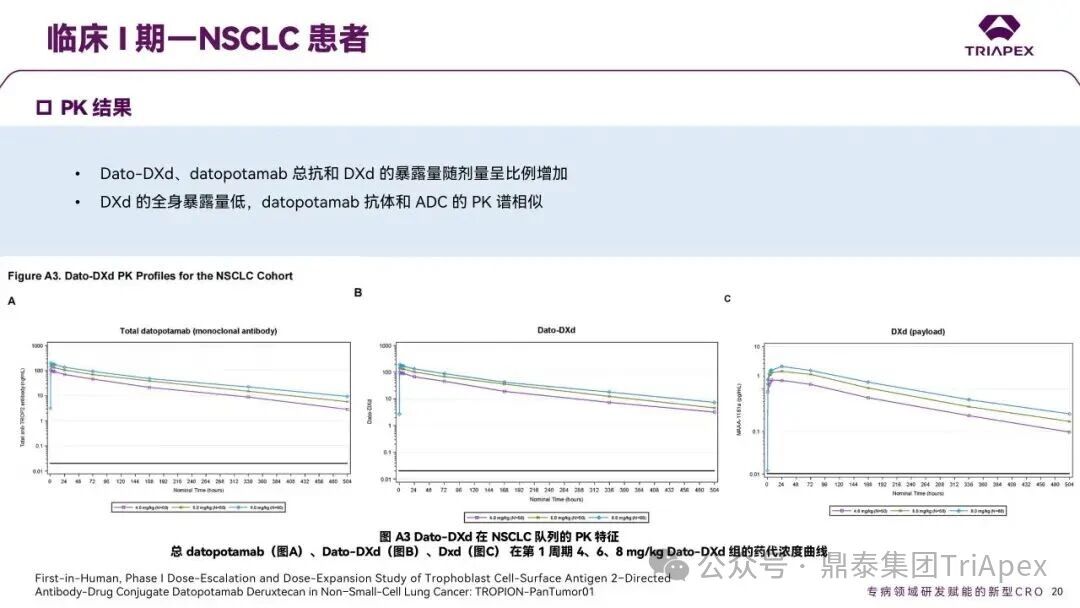
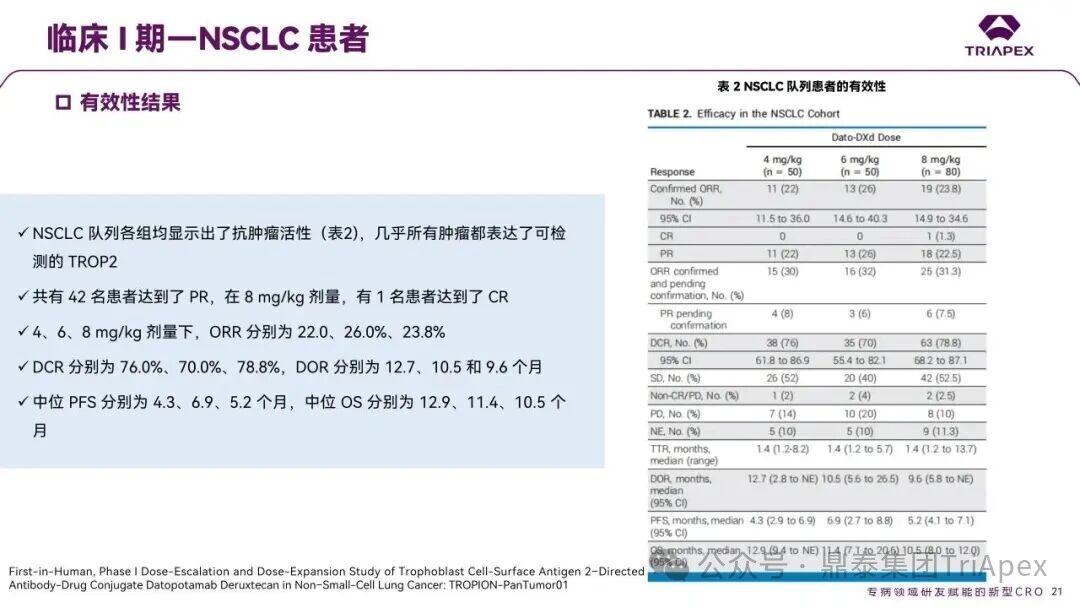
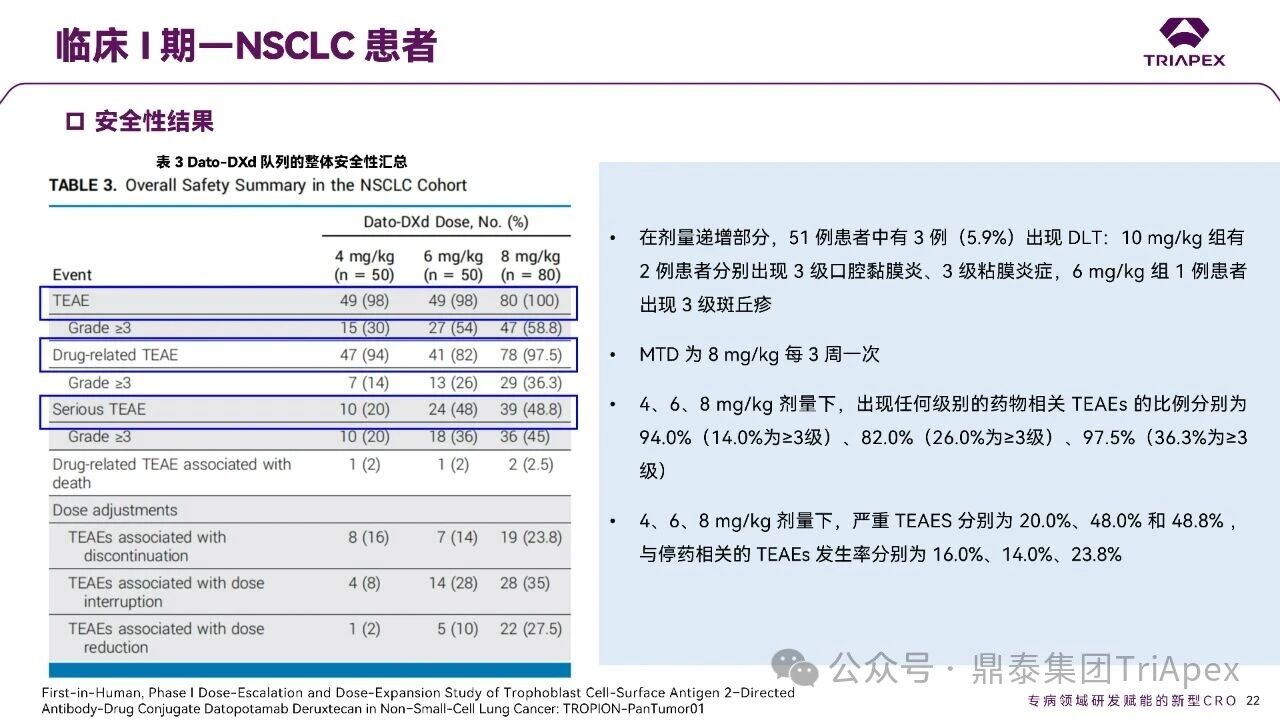
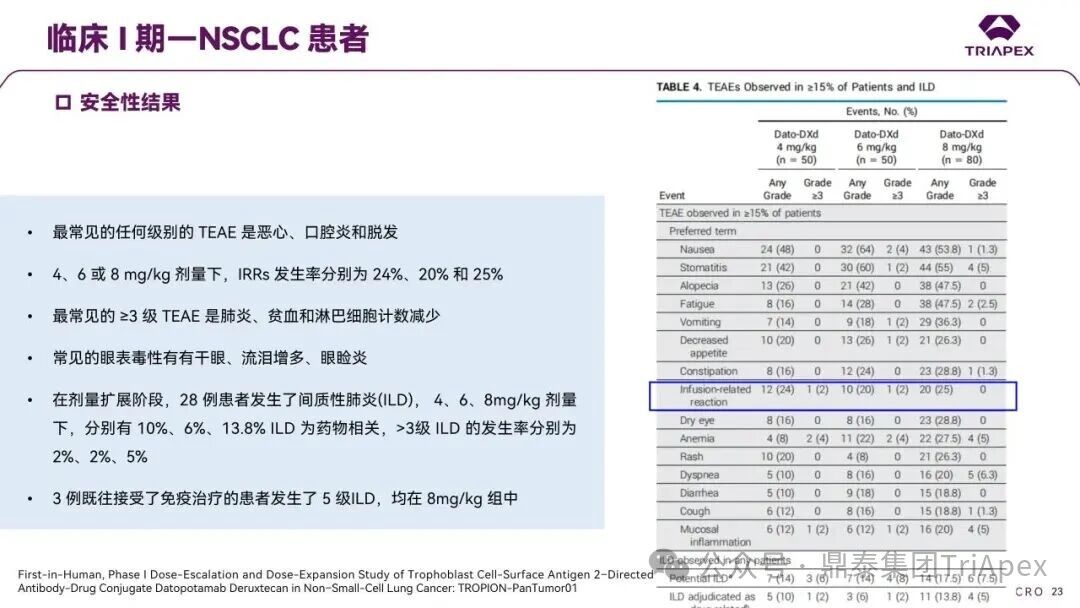
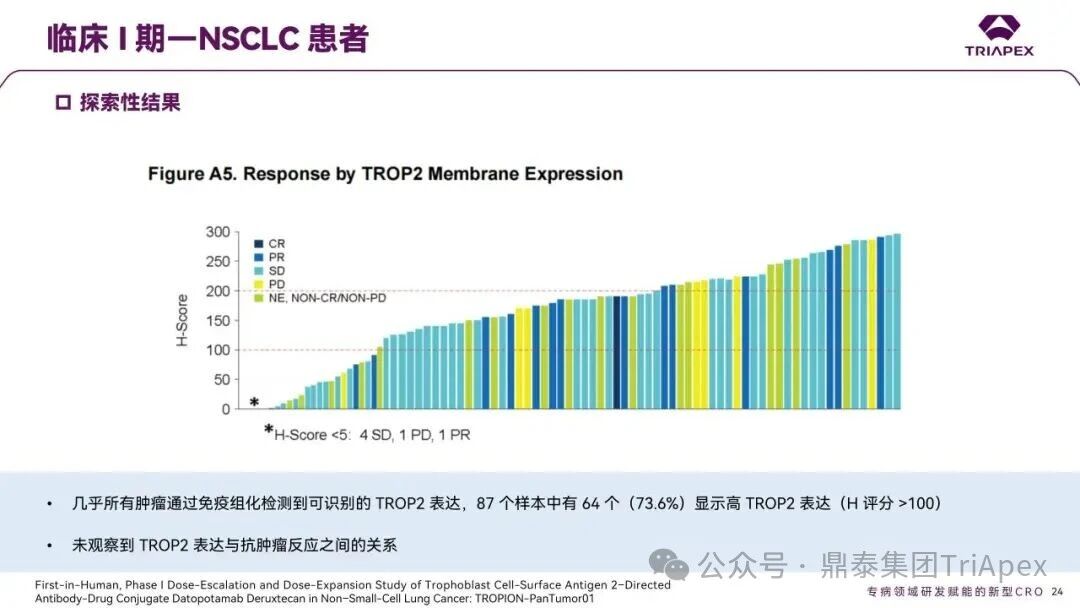
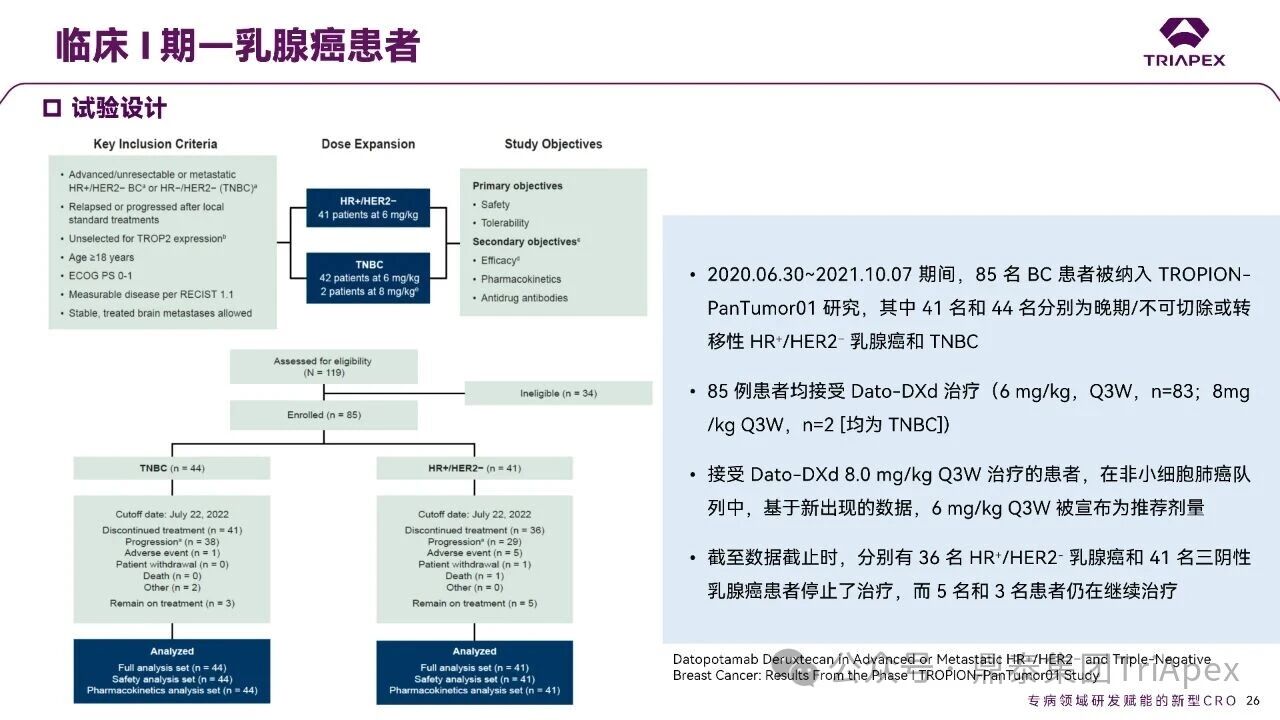
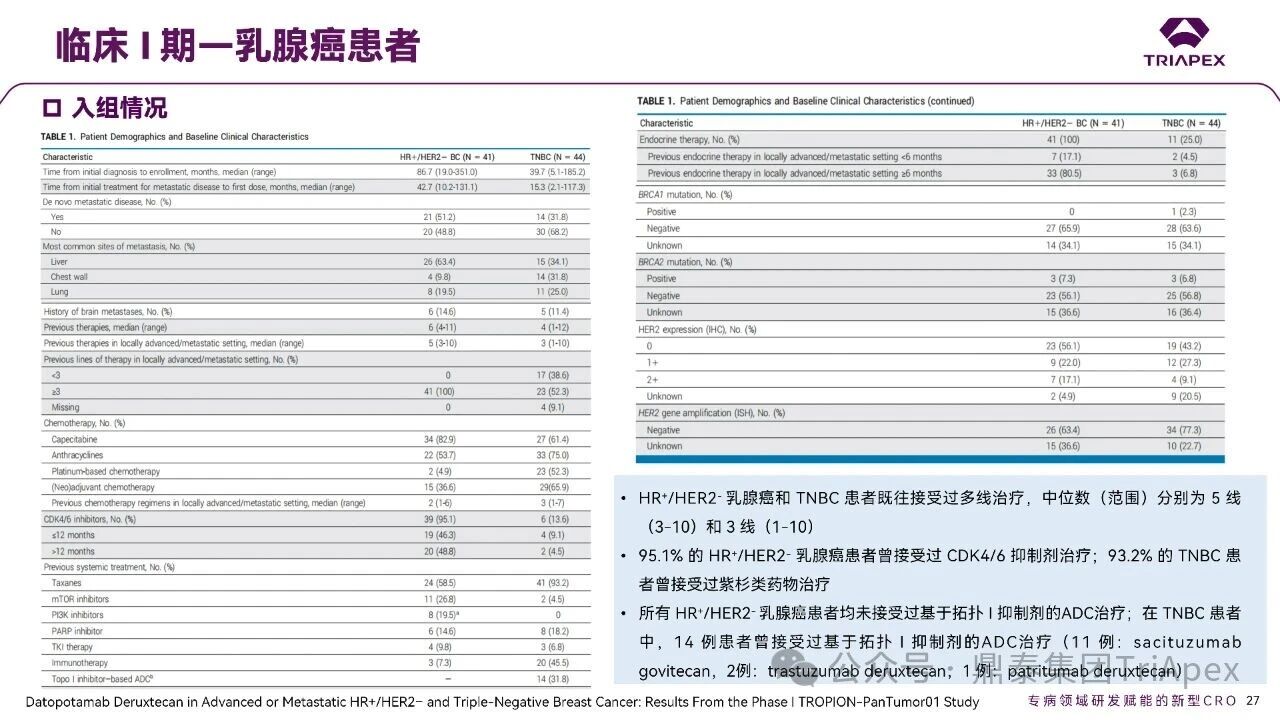
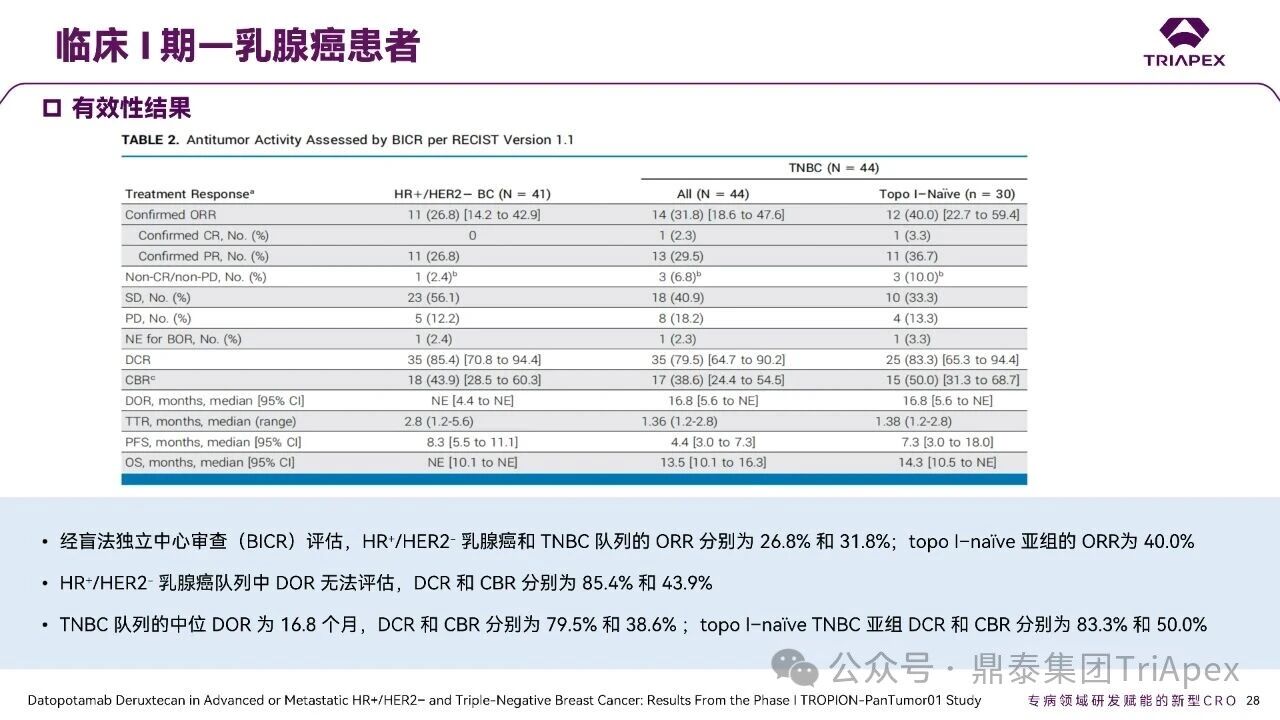
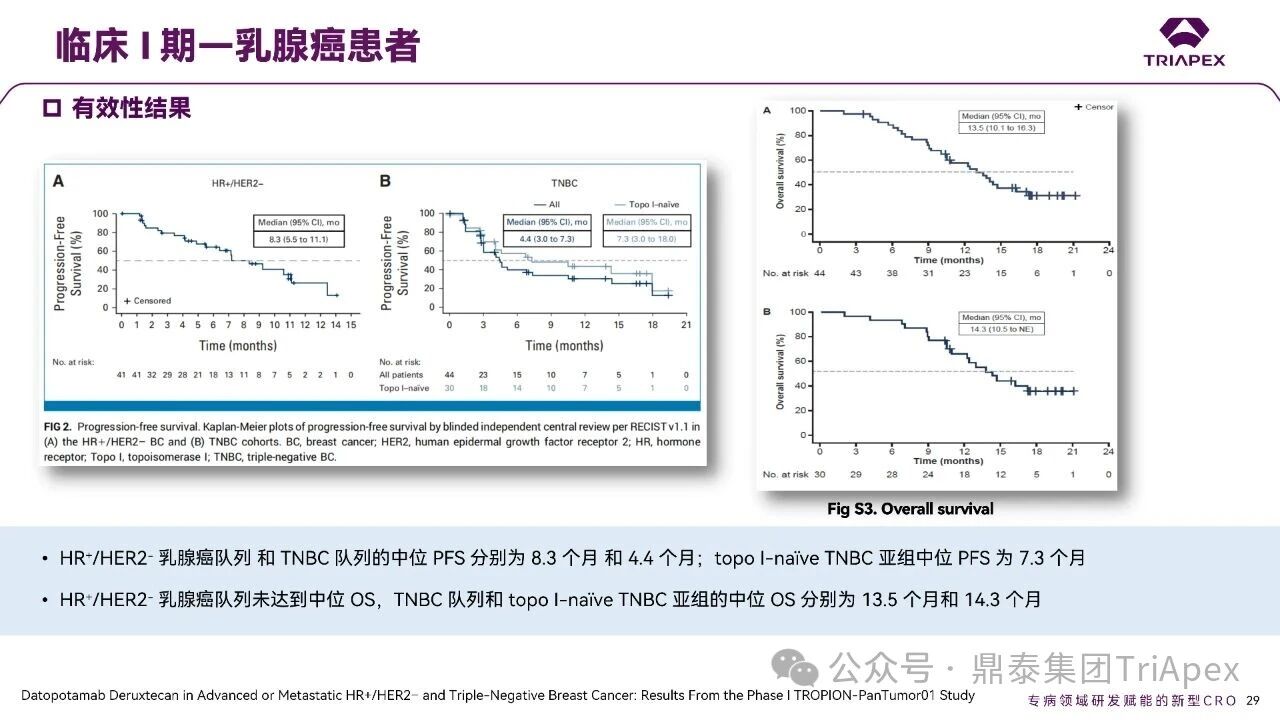
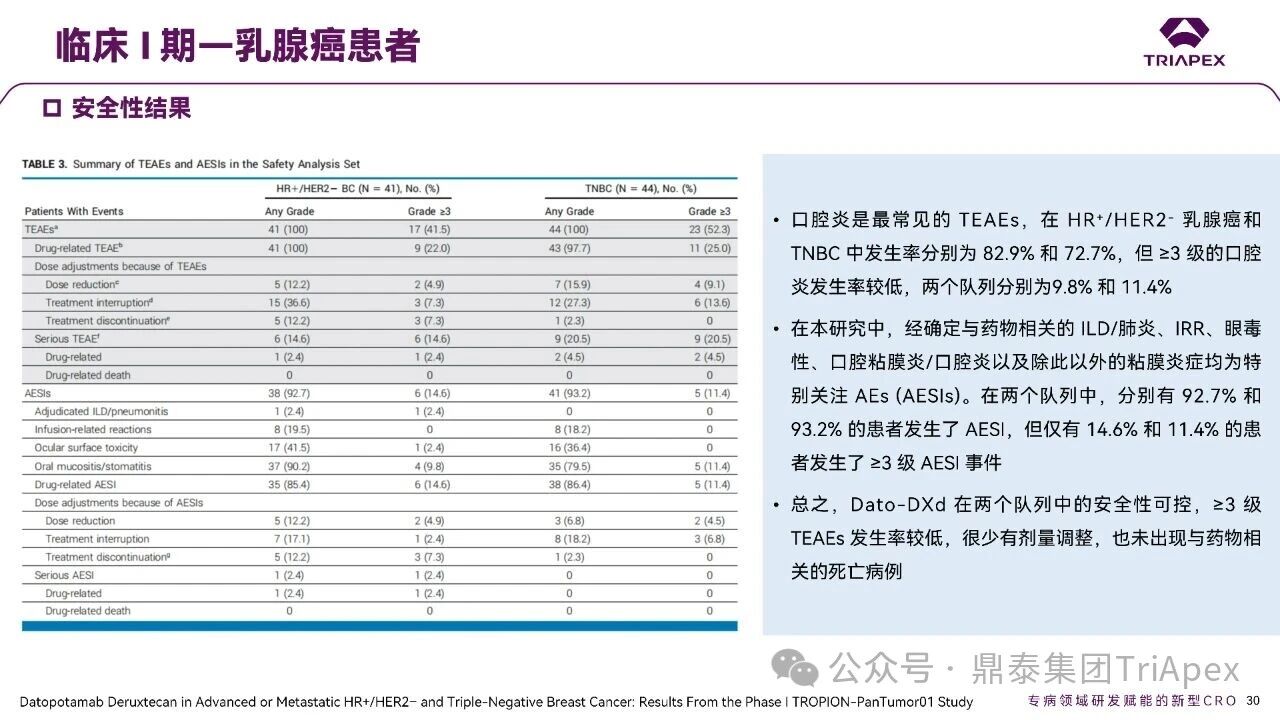
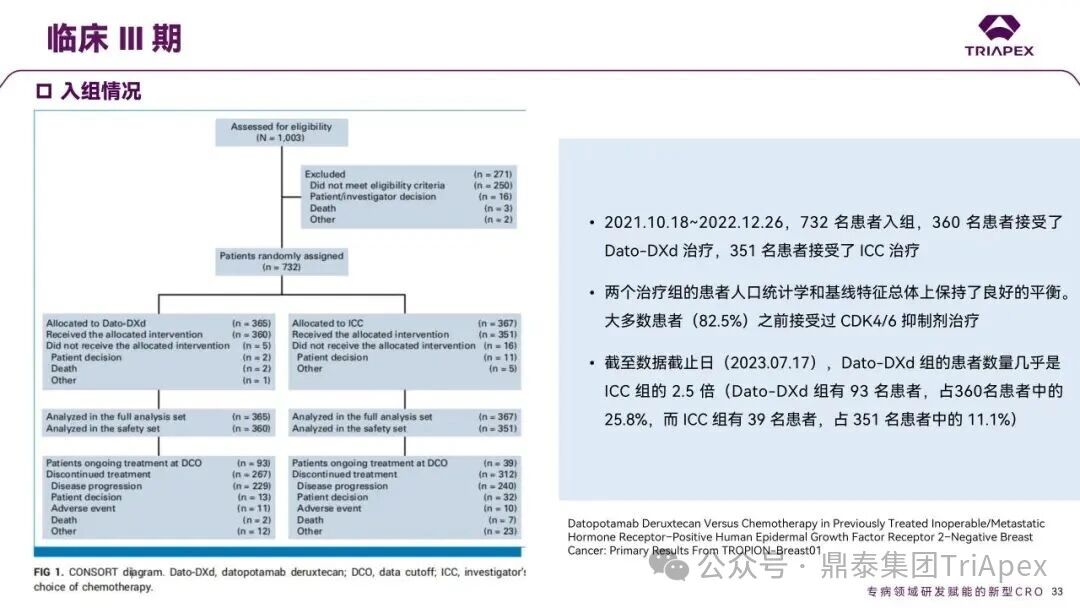
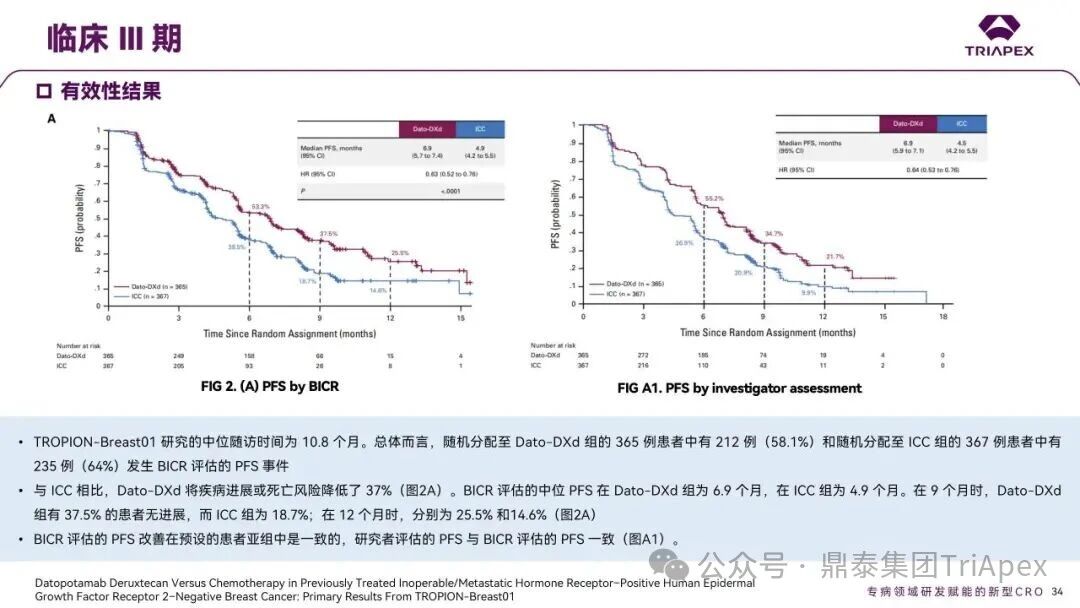
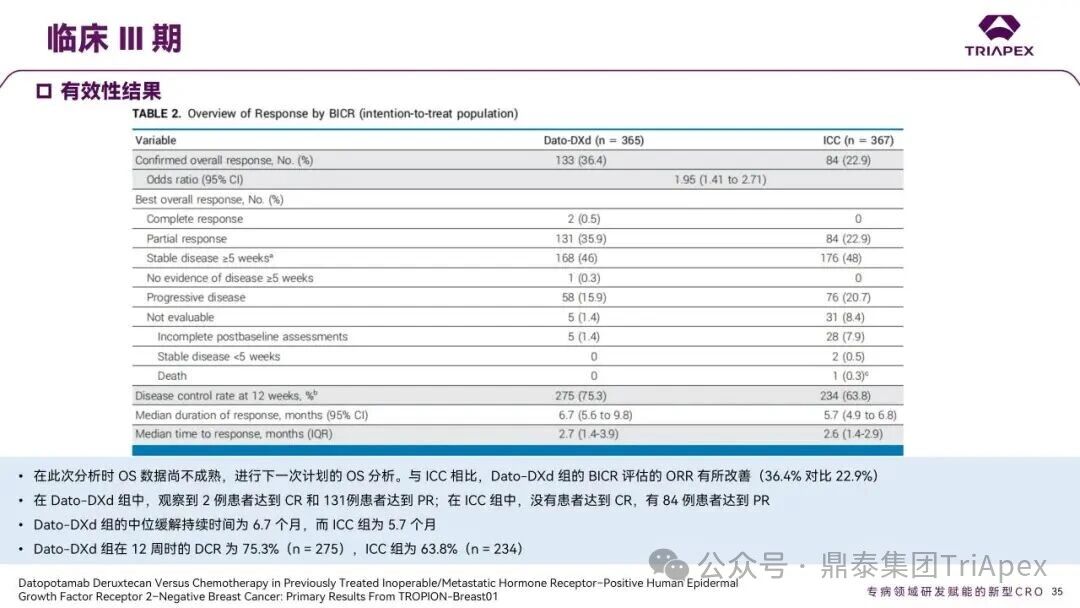
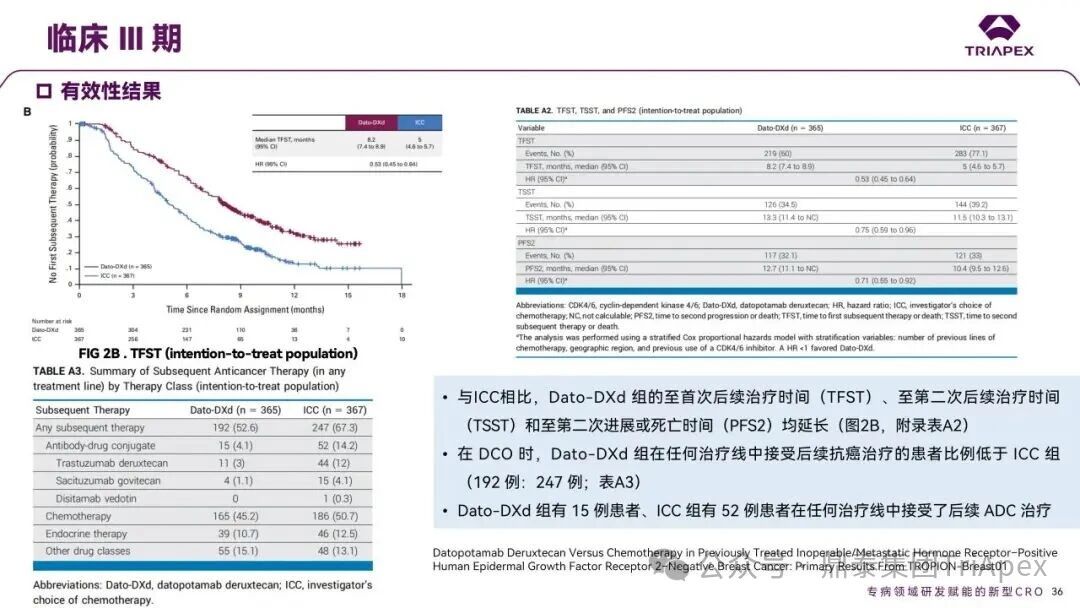
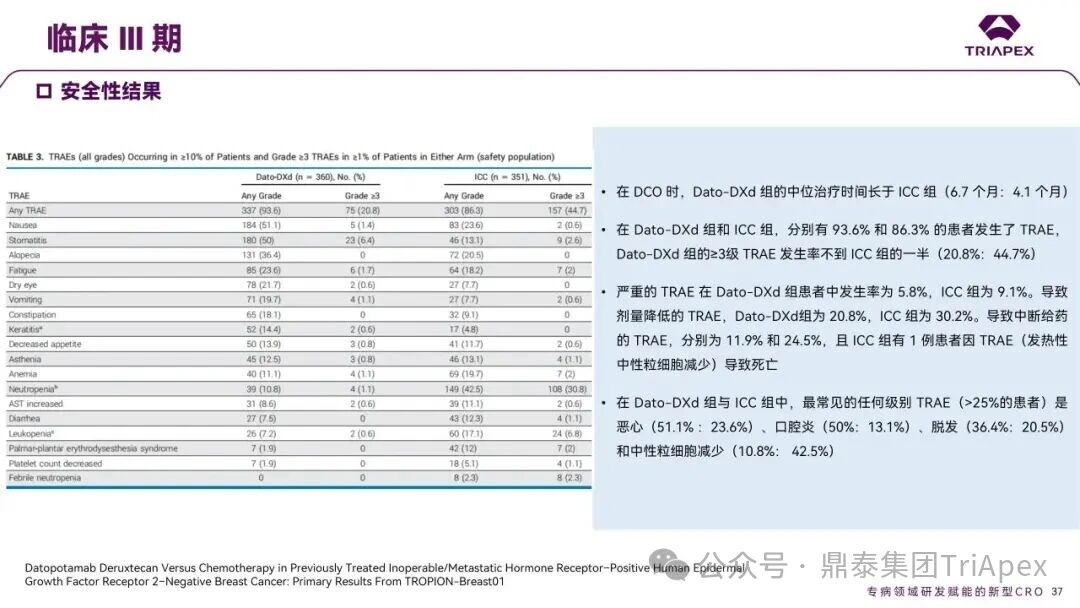
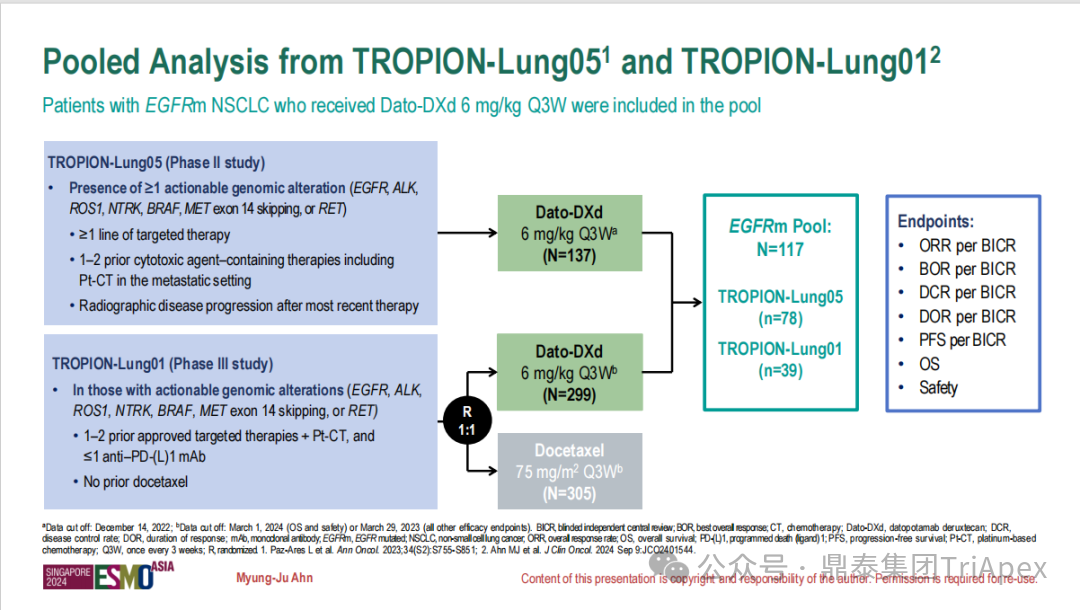
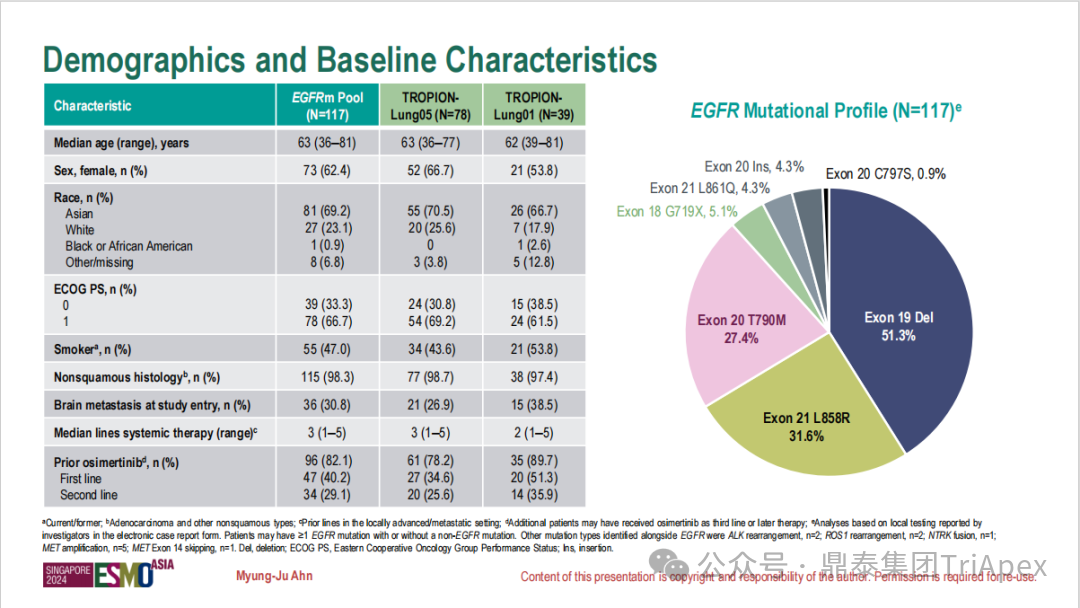
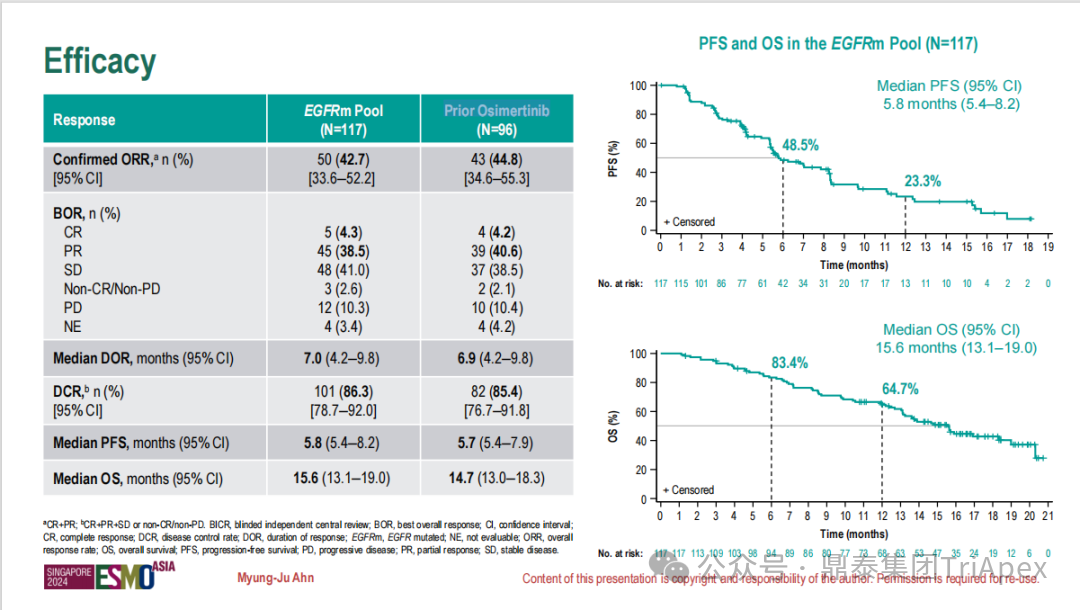
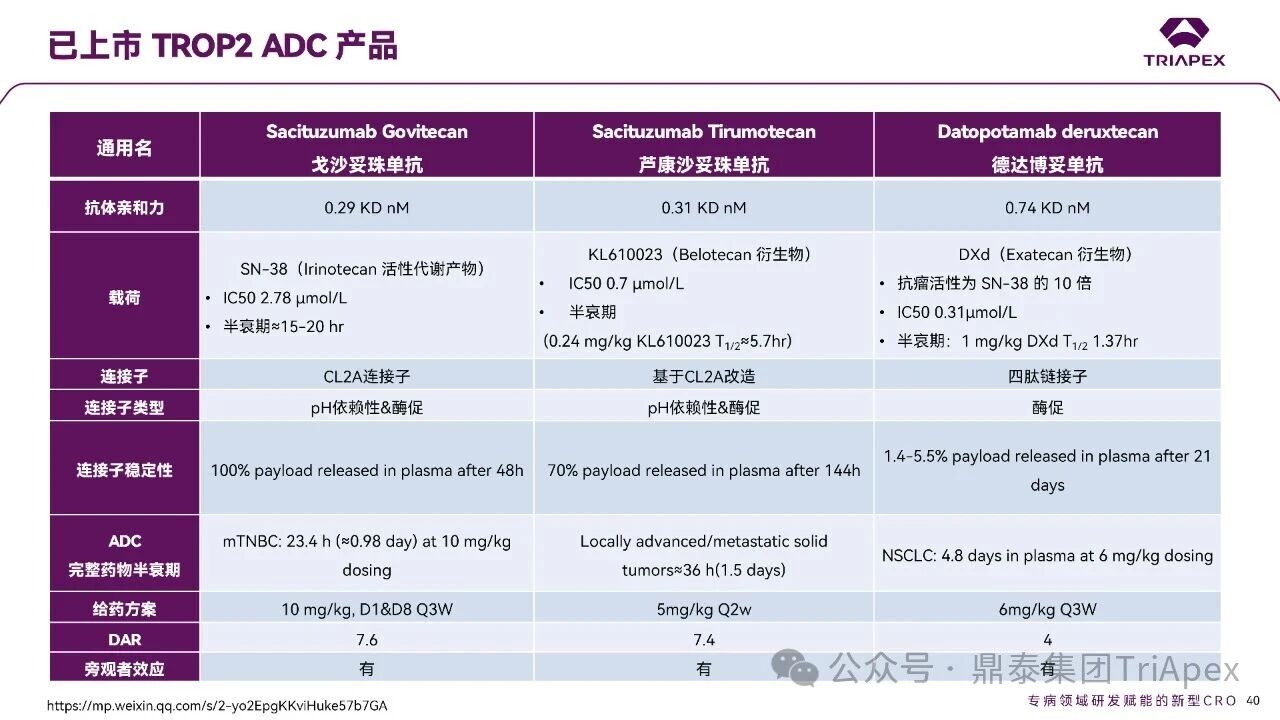
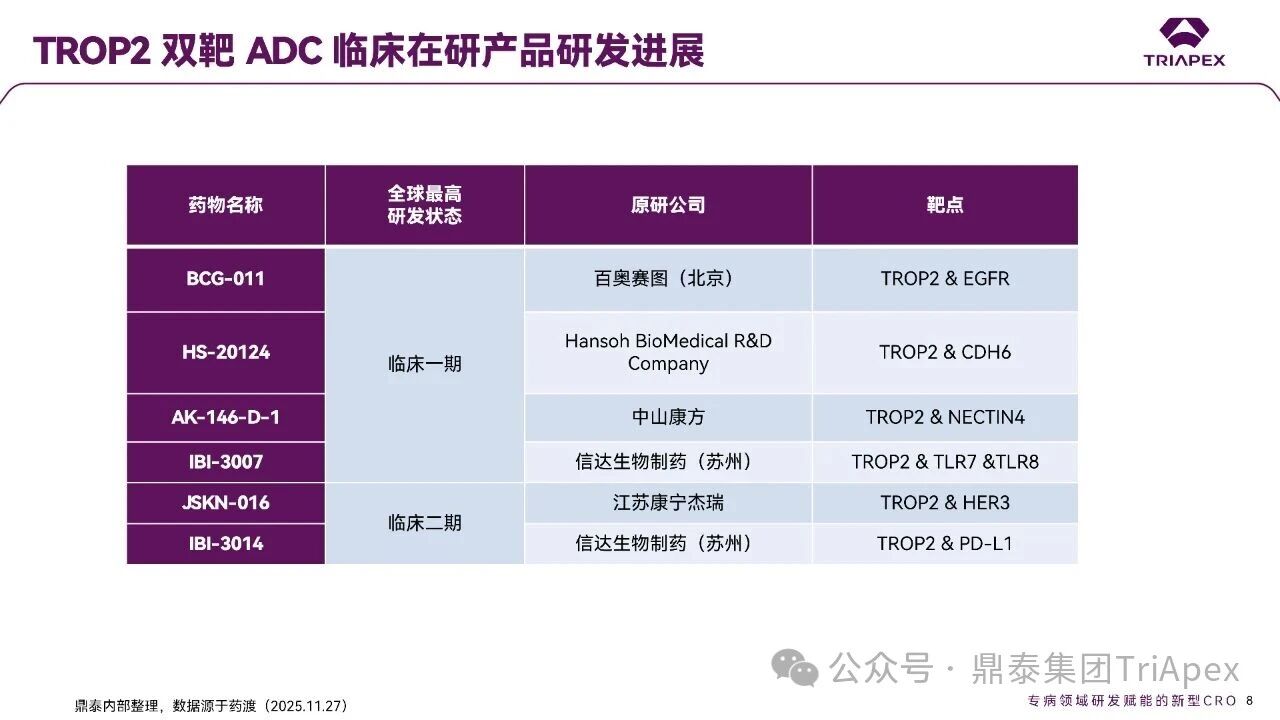
德达博妥单抗(Datopotamab deruxtecan,Dato-DXd)作为全球第二款获批上市的靶向 TROP2 的 ADC,在非小细胞肺癌和乳腺癌领域占据重要地位。然而,其上市之路并非一帆风顺,曾两度主动撤回申请,历经波折。最终,凭借研发策略的灵活优化和确证性临床试验的积极结果迎来转机,并引领了 TROP2 及相关双靶点 ADC 药物研发的热潮。 TROP2 为何被视作肿瘤治疗领域的“黄金靶点”? 从非临床探索到临床验证,直至最终获批,Dato-DXd 经历了怎样跌宕起伏的研发历程? 作为第二款以 DXd 为 Payload 的 ADC,其非临床研究内涵有哪些延伸? 在竞争日益激烈的 TROP2 ADC 赛道中,Dato-DXd 凭借哪些核心优势脱颖而出? 其上市历程和研发经验为后续 ADC 药物开发带来了哪些重要启示? 本期内容,鼎泰团队将系统梳理 Dato-DXd 的上市历程,从研发策略到关键临床数据,深入解析其成功背后的研发逻辑,并探讨其经验对未来 ADC 药物开发的借鉴意义。同时,也以此文致敬坎坷与收获深度交织的 2025 年! 声明 本文仅为行业科普及学术研究用途,不构成对任何药品、医疗器械或相关产品的推广、推荐或商业宣传。文中提及内容均基于公开资料,不涉及具体产品功效暗示或商业利益关联;若与特定品牌或产品名称有所提及,均为事实描述,不代表任何商业导向。请读者勿将相关信息作为医疗建议或购买依据,任何诊疗或用药请遵从专业医师意见。 ★ 文章导览 ★ 01 研发背景 1.1 从 HR+HER2- 乳腺癌谈起 1.2 TROP2 ADC,突破 HR+HER2- 乳腺癌治疗瓶颈的新选择 02 Dato-DXd 的非临床研究 2.1 Dato-DXd 产品信息 2.2 支持 IND 和 BLA 的非临床研究 2.3 非临床研究的转化价值 03 Dato-DXd 的临床开发路径 3.1 从希望到挫折,再到曙光的坎坷之路 3.2 聚焦 NSCLC 和 BC 适应症开发策略的由来 3.3 Ⅰ期临床试验:剂量递增和初步疗效探索 3.4 关键临床试验:精准设计和有效性确认 04 TROP2 ADC 竞品分析 05 结语 研发背景 对 TROP2 与 TROP2 ADC 的关注 1.1 从 HR+HER2- 乳腺癌谈起 乳腺癌(Breast Cancer,BC)是女性中最常见的癌症(不包括皮肤癌),约占所有女性癌症的 1/3[1]。目前,临床乳腺癌主要分为三种主要亚型,包括 HR+/HER2- BC、HER2+ BC、HR-/HER2- 或三阴性乳腺癌(TNBC)。其中,HR+/HER2- BC 是最常见的亚型,占所有 BC 的 65%-75%。在早期阶段,HR+/HER2− BC 的预后比其他亚型更好;然而,一旦 HR+/HER2- BC 发展为局部晚期或转移性,通常预后较差[2]。 不可切除或转移性 HR+HER2- BC 目前仍无法治愈,治疗以缓解症状、延缓疾病进展和延长生存期为目标。基于几项 III 期研究的结果和当前的临床指南[2][3],局部晚期/转移性 HR+HER2- BC 患者的首选 1 线标准治疗是周期蛋白依赖性激酶 4 和 6 抑制剂(CDK4/6)联合内分泌治疗(Endocrine Therapy,ET),疾病进展后可继续接受基于内分泌治疗的方案。当内分泌治疗不再获益时,患者往往转向连续的单药化疗,但疗效有限且副作用显著。 尽管德曲妥珠单抗和戈沙妥珠单抗两款 ADC 药物已获批用于特定类型乳腺癌的治疗,然而对于先前接受过系统性治疗的 HR+HER2- 乳腺癌患者,仍存在尚未被满足的临床需求:一方面,现有 ADC 带来的生存获益仍较为有限;另一方面,部分 ADC 药物存在给药频率偏高、不良事件发生率较高等耐受性问题[2]。因此,临床上迫切需要疗效更优、耐受性更好的治疗药物。 1.2 TROP2 ADC,突破 HR+HER2- 乳腺癌治疗瓶颈的新选择 人类滋养层细胞表面抗原2(Human trophoblastic cell surface antigen 2,TROP2)是一种跨膜糖蛋白,具有肿瘤细胞过表达、组成型内吞、可转送至溶酶体等特性[4],主要通过调节钙离子信号通路和周期蛋白表达来促进细胞生长和增殖。在正常上皮细胞中,TROP2 的表达水平较低。但在肿瘤组织中(图 1 ),TROP2 的表达相对正常组织明显上调,其过表达可促进肿瘤增殖、侵袭、转移及耐药性,并与不良预后显著相关。这种“肿瘤特异性”表达模式使得 TROP2 成为理想的抗癌靶点[5][6]。研究显示,约 80% BC 患者过表达 TROP2[7],这种高表达特征与组织学分级升高、淋巴结受累、肿瘤远处转移以及更严重的 TNM(Tumor Node Metastasis,肿瘤-淋巴结-转移) 分期密切相关,并可能促进机体的耐药性[8][9][10]。 图 1. TROP2 在各种实体瘤中的表达分布[7] TROP2 因在肿瘤治疗领域展现出巨大的治疗潜力而成为行业焦点,全球研发热潮持续升温。截至目前(2025.12.26),已有 30 余款 TROP2 靶向疗法(以 ADC 药物为主)进入临床阶段,赛道竞争日趋白热化。在这场激烈的角逐中,戈沙妥珠单抗(Immunomedics,Sacituzumab govitecan)、德达博妥单抗(Daiichi Sankyo,Datopotamab deruxtecan)与芦康沙妥珠单抗(Klus Pharma Inc,Sacituzumab tirumotecan)均已获批上市,是 TROP2 ADC 药物领域临床应用及探索的重要代表。此外,以 TROP2 为基石构建的双抗 ADC 也不断涌现,如 IBI-3014、AK-146-D-1、BCG-011 等…… Dato-DXd 的非临床研究 支持临床转化的重要科学依据 2.1 Dato-DXd 产品信息 Dato-DXd 由可切割的 GGFG 四肽连接子,将人源化 IgG1 TROP2 单克隆抗体(MAAP-9001a, Dato)与 MAAA-1181a(DXd) 共价连接而成,DAR 为 4。目前,该产品先后于日本、美国、欧盟、中国等多个国家或地区获批上市,临床推荐剂量为 6 mg/kg ,静脉输注给药,每 3 周一次(Q3W),直至出现疾病进展或不可接受的毒性反应。 当 Dato-DXd 与细胞表面的 TROP2 结合时,Dato-DXd 被内吞使活性成分 DXd 在细胞质中通过蛋白酶切割释放,从而诱导 DNA 损伤和细胞凋亡发挥抗肿瘤作用[13]。在分子设计之初,通过改造 Dato-DXd 的抗体 MAAP-9001a,降低了对 TROP2 的亲和力,使 Dato-DXd 仅与 TROP2 高表达的肿瘤细胞结合,降低与正常组织的结合,从而确保了 Dato-DXd 在精准、高效杀伤肿瘤细胞的同时减轻对正常细胞的毒性。 图 2. Dato-DXd 作用机制[13] 2.2 支持 IND 和 BLA 的非临床研究 为支持 Dato-DXd 的 IND 和 BLA,申请人先后开展了多项药理学、PK(ADME)和毒理学研究。同时,我们也关注到,作为第二款以 DXd 为 Payload 的 ADC,第一三共针对 DXd 开展了更为精细的毒理学和 ADME 研究。 药理学 体外研究表明,Dato-DXd 仅与食蟹猴 TROP2 结合,从而确认食蟹猴为药理学相关种属;Dato-DXd 的活性依赖于 TROP2 的表达,对多种 TROP2 阳性细胞具有生长抑制作用,可介导 ADCC 效应。小分子毒素 DXd 主要通过抑制 DNA 拓扑异构酶 I 诱导 DNA 损伤。体内研究显示,在不同肿瘤小鼠模型中,Dato-DXd 显示出较高的抗肿瘤活性,且呈剂量依赖性。以上为比较经典的 ADC 药效学研究内容。 药代动力学 针对 Dato-DXd ,开展了食蟹猴单次静脉注射的 PK 研究和体外血浆稳定性研究。DXd 在人血浆中的平均血浆蛋白结合率最高(96.8%–98.0%),其次为大鼠、小鼠和猴血浆。37℃ 孵育 21 天后,DXd 从 Dato-DXd 中的释放率低,表明其在血浆中稳定性较高。 在对现有资料进行仔细对比后发现,针对此前已获批产品德曲妥珠单抗(DS-8201a),申请人开展了经放射性标记的 DS-8201a(ADC 形式)和 DXd (Payload 形式)的相关药代研究;针对 Dato-DXd ,在借鉴 DS-8201a 原有研究的基础上,针对 DXd (Payload 形式)进一步开展了经 14C 放射性标记的食蟹猴分布、代谢和排泄研究。这些新开展的研究,可能涉及企业自身的研发策略、逆向临床转化或其他因素,有待我们进一步核实和了解。 毒理学 为充分评估 Dato-DXd 及 DXd 的毒性,申请人在非相关种属(大鼠)中进行了重复给药毒理学研究。根据公开的审评资料,申请人未在具有药理学活性的食蟹猴中进行 Dato-DXd 短周期的 GLP 毒理试验,而是直接开展了重复给药 3 个月毒性试验,以支持其临床试验申请及上市申请。推测可能的原因是——结合产品适应症、ICH S9 中支持上市的非临床毒理试验相关描述( 3 个月的非临床毒性试验,足以支持大多数用于治疗晚期肿瘤患者产品的上市)及“3R 原则”,同时考虑到该产品采用与 DS-8201a 相同的连接子和毒素分子,且食蟹猴重复给药预试验中 Dato-DXd 的安全性良好,这是一种基于科学决策的研究策略。 针对 DXd,申请人引用了 DS-8201a 中的一般毒理学、遗传毒理学、光安全性评价,未开展新的研究。 根据 ICH S9,未开展致癌性研究及生殖与发育毒性研究;重复给药毒理学研究结果表明,Dato-DXd 可能损害雄性和雌性生育力。此外,基于文献及 Dato-DXd 的作用机制,FDA 建议在说明书中增加胚胎-胎仔毒性警告,并建议有生育能力的女性及伴侣采取有效的避孕措施。 2.3 非临床研究的转化价值 2.3.1 支持 FIH 试验起始剂量设计 在 Dato-DXd 的首次临床(FIH)试验中,最大推荐起始剂量为 0.27 mg/kg。主要设计依据如下: 根据 ICH S9,抗肿瘤药物推荐以啮齿类动物 STD10 的 1/10 和/或非啮齿类动物 HNSTD 的 1/6 作为起始剂量设计的依据。申请人同时考虑到 Dato-DXd 食蟹猴 3 个月重复给药试验出现较高的免疫原性并影响药物暴露,故保守地将 HED 设定为 HNSTD 的 1/12,并通过 PK 建模模拟验证 采用药效学试验及建模进行有效性验证 2.3.2 症状关联性提示安全风险 在非临床研究中,观察到 Dato-DXd 相关的多器官可逆性毒性,如肺脏(从审评报告来看未明确是 ILD)、胃肠道、角膜,这些毒性与 TROP2 靶点分布相关。在大鼠和食蟹猴中开展的 DXd 重复给药的毒理学研究结果显示,在胃肠道、淋巴造血器官及眼部等靶器官具有安全性风险,但多数可逆。非临床研究支持其临床安全性评估,且与人体不良反应的一致性较高。 Dato-DXd 的说明书中提到(2025.01),临床上最常见的不良反应(发生率≥ 20%)包括口腔炎、恶心、白细胞减少、淋巴细胞减少、干眼症、呕吐、角膜炎等。此外,间质性肺病(ILD)/肺炎、眼部毒性和口腔炎被认定为严重且足以列入说明书“警告和注意事项”部分的安全性问题,因此在“警告和注意事项”中,提示在用药过程中,需监测患者的症状,视情况调整用药。 针对上述严重安全性风险,FDA 采用了一个由 TROPION-Lung01、05、TROPION-PanTumor01 和 TROPION-Breast01 研究中 927 例 NSCLC 或乳腺癌患者组成的汇总安全性人群(BLA 761464),用于评估口腔炎和眼部毒性,具体汇总分析见表 1。 因观察到 ILD /肺炎的发生率在 NSCLC 患者与乳腺癌患者间存在差异,FDA 在 TROPION-Lung01、05、 TROPION-PanTumor01 研究中 484 例 NSCLC 患者组成的汇总安全性人群中进行了评估(BLA 761464):ILD /肺炎发生率为 7%,其中 0.6% 为 3 级,0.4 %为 4 级,此外还有8例致死病例(1.7%)。 ILD /肺炎导致 2.3% 的患者中断给药,4.1% 的患者永久停药。 FDA 在风险与风险管控中提到(BLA 761464),尽管 Dato-Dxd 可能引发严重毒性反应,但产品说明书中“警告与注意事项”及“用法用量”章节的相关信息已充分阐明这些安全性问题。在评估其用于危及生命的疾病治疗时,观察到的安全性特征被认为可接受。 图 3. Dato-DXd 审评报告(BLA 761464) 综上,Dato-DXd 的非临床研究策略兼顾研发效率与表征深度 —— 采用与 DS-8201 相同的连接子和毒素,加速了前期开发;未按照传统的分阶段毒理评价思路,直接开展 3 个月的毒理试验,支持了长期用药的安全性评估并加快临床开发进程;非临床结果为 FIH 起始剂量提供了依据,并为后续临床用药给予风险提示。 Dato-DXd 的临床开发路径 韧行与睿至 目前, Dato-DXd 已在日本、美国、欧洲及中国获批上市,获批的适应症为既往治疗过的不可切除或转移性 HR+HER2- BC 患者和 EGFR 基因突变阳性、局部晚期或转移性 NSCLC 患者。 3.1 从希望到挫折,再到曙光的坎坷之路 图 4. Dato-DXd 上市历程(鼎泰内部整理) 2024 年 12 月,Dato-DXd 首次在日本获批上市,适应症为“接受过化疗的不可切除或复发性 HR+HER2- BC 患者”。随后,该适应症(或类似适应症)于次年分别在美国、欧盟获批【在 FDA 递交申请时,OS 数据尚未成熟,详见 3.4 关键临床试验】,并于今年 8 月在中国获批上市。这一适应症在全球范围内的成功获批,看似为 Dato-DXd 的国际化征程铺平了道路,但其开发历程并非一帆风顺,另一适应症的上市申请在欧美市场经历了较为坎坷的监管历程 —— 主动撤回上市申请。这背后的原因与战略考量,成为了业界的关注点。 2024 年 11 和 12 月(也就是 HR+HER2- BC 适应症在日本获批的前后),申请人分别在美国和欧盟撤回了 Dato-DXd 用于治疗“晚期或转移性非鳞状非小细胞肺癌(Non-Squamous Non-Small Cell Lung Cancer,NSQ-NSCLC)患者”的上市申请,原因在于 Dato-DXd 的风险(包括观察到的毒性)可能超过获益(PFS 改善相对有限);此外,由于 TROPION-Lung01(III 期) 缺乏非鳞状 NSCLC 亚组 PFS 和 OS 的预设统计分析,加上 Dato-DXd 在非鳞状 NSCLC 疗效优于鳞状 NSCLC 的生物学机制尚不明确,进一步限制了 Dato-DXd 的获益-风险评估。然而,在该临床试验亚组数据的审查过程中,FDA 发现 Dato-DXd 在 EGFR 突变型(EGFRm) NSCLC 患者中具有很好的疗效…… 表 2. TROPION-Lung01 所有患者及按组织学分类的总体疗效[14] 基于上述 FDA 在 TROPION-Lung01 亚组数据中的发现,申请人立即提交了适应症为“既往治疗过的晚期 EGFRm NSCLC 患者”的 BLA。由于该适应症下的患者有着较为迫切和未满足的临床需求、Dato-DXd 的关键临床试验 (TROPION-Lung01、05)疗效优于现有疗法(ORR 为 45%,mDoR 为 6.5 个月)、并且在说明书中已充分阐明安全性问题,FDA 综合分析后认为尽管 Dato-DXd 有部分严重毒性风险,但也是可接受的。随后,该适应症获得了突破性疗法认定(BTD)和优先审评,并于今年 06 月获得 FDA 加速审批上市,成为美国首个 TROP2 靶向肺癌药物,为更多晚期肺癌患者填补了关键的治疗空白[2]。 此外,根据第一三共官网(2025 年 12 月 18 日)披露的信息,Dato-DXd 在欧盟的第二个适应症目前正处于审评阶段。该适应症针对的是不适合接受 PD-(L)1 抑制剂治疗的、不可切除或转移性三阴性乳腺癌成人患者,用于一线(1L)治疗。 图 5. Dato-DXd TNBC 适应症受理文件的 (图片源于第一三共官网) 3.2 聚焦 NSCLC 和 BC 适应症开发策略的由来 Dato-DXd 的成功上市,离不开第一三共/阿斯利康针对性的临床试验战略布局 —— 从“广谱”探索到“精准”突破的经典模式:首先在涵盖多种实体瘤的 I 期( TROPION-PanTumor01 )研究中验证其基本的安全性和初步疗效,随后基于 NSCLC 和 BC 中观察到的治疗潜力,在这两类人群中展开了规模较大、覆盖不同治疗阶段的临床试验。 图6. Dato-DXd 在 NSCLC 治疗中的临床布局 (蓝色标注为 Dato-DXd,图片源于第一三共研发日材料-2025.12.15) 图 7. Dato-DXd 在乳腺癌治疗中的临床布局 (蓝色标注为 Dato-DXd,图片源于第一三共研发日材料-2025.12.15) 从后线向前线推进:在 NSCLC 领域,首先在全球多中心Ⅲ期临床研究 TROPION-LUNG01 中,证实其疗效在经治患者中优于现有化疗(对比多西他赛,显著改善 PFS 和 OS);然后逐步向更前线(如一线)的治疗场景推进,如 TROPION-LUNG07、LUNG08 等。在 BC 领域,除了向 HR+HER2- BC 和 TNBC 人群前线(包括一线、辅助和新辅助)治疗的拓展外,还与德曲妥珠单抗配合完成了对不同类型乳腺癌人群的全覆盖。 从单药到 IO+ADC 联合治疗:利用 ADC 药物可能引发的免疫反应,与免疫抑制剂联合,产生“1+1>2” 的协同效应。如在 TROPION-Lung07/08、AVANZAR中,通过 Dato-DXd 与不同免疫疗法(帕博利珠/度伐利尤) ± 化疗的联合,试图探索更优的一线治疗策略。 图 8. Dato-DXd 联合治疗组合总览 (黄色标注为 Dato-DXd,图片源于第一三共研发日材料-2025.12.15) 图 9. Dato-DXd + IO 联合治疗 (图片源于第一三共官网) 此外,第一三共/阿斯利康还启动了 ADC + 靶向治疗的联合治疗探索之路。首先在 ORCHARD 中确定奥希替尼的耐药机制,随后在 TROPION-Lung14、TROPION-Lung15 中评估 “ADC + 靶向药” 这种新型联合疗法在精准后线治疗中的价值,甚至直接挑战标准化疗。 图 10. Dato-DXd + 靶向治疗 (图片源于第一三共官网) 然而,任何战略布局的最终实现,都必须有坚实的临床数据作为基石。Dato-DXd 临床疗效到底如何?安全性风险是否可控?支持其上市的关键临床试验又是哪些?将在后文中进行解答。 3.3 Ⅰ 期临床试验:剂量递增和初步疗效探索 Dato-DXd 开展的首个临床试验是 TROPION-PanTumor01(NCT03401385),一项剂量递增和剂量扩展的 I 期临床研究,在既往接受过治疗的实体瘤患者中开展。主要终点是评估 Dato-DXd 的安全性和耐受性,并确定 MTD 和扩展推荐剂量(RDE);次要终点包括评估抗肿瘤活性、药代动力学和免疫原性(ADA)的发生率等。具体试验设计及入排标准如下: 此外,针对不同适应症,入排标准各异: NSCLC:经病理学证实的不可切除晚期 NSCLC 患者,且不适合根治性治疗 TNBC:根据 ASCO-CAP 指南,经病理学证实的晚期/不可切除或转移性 HR-HER2- BC HR+HER2- BC:经病理学证实不可切除或转移性乳腺癌;至少接受过 1 种内分泌治疗后病情进展,且经研究者判定无法从后续内分泌治疗中获益;在晚期/转移性情况下,既往接受过 1 至 3 线化疗,CDK4/6 抑制剂不计入化疗次数 SCLC:经病理学证实的不可切除或转移性且/或广泛期 SCLC,患者之前已接受过 1~2 线治疗,包括铂类化疗和免疫检查点抑制剂;既往未接受过托泊替康治疗 …………………… 3.3.1 组别设计及研究结果 NSCLC 队列 试验设计 Dato-DXd 的首次人体临床试验首先在局部晚期/转移性 NSCLC 患者中进行。在剂量递增部分,患者每 3 周接受一次 0.27~10 mg/kg Dato-DXd;在剂量扩展部分,患者每 3周 接受一次 4、6 或 8 mg/kg Dato-DXd。主要终点是安全性和耐受性。次要终点包括 ORR,生存率和药代动力学。 试验结果 210 名患者接受了 Dato-DXd 治疗,其中 4~8 mg/kg 剂量扩展队列中有 180 名患者。该人群的既往治疗线数的中位数为 3。最大耐受剂量为 8 mg/kg Q3W;进一步开发的推荐剂量为 6 mg/kg Q3W。 在接受 6 mg/kg(n=50) 的患者中,研究的中位持续时间(包括随访)和中位暴露时间分别为 13.3和 3.5 个月。最常见的任何级别的 TEAE 为恶心(64%),口腔炎(60%)和脱发(42%)。54% 和 26% 的患者分别发生 ≥3 级 TEAE 和 TRAE。50 名患者中有 3 名(6%)发生了被判定为与药物相关的 ILD (2 例 2 级和 1 级 4 级)。ORR 为 26%(95%CI,14.6-40.3),中位缓解时间为 10.5 个月;中位无进展生存期和总生存期分别为 6.9 个月(95%CI,2.7-8.8)和 11.4 个月(95%CI,7.1-20.6)。 无论 TROP2 表达如何,均能产生抗肿瘤效果。 小结 Dato-DXd 在重度治疗的晚期 NSCLC 患者中具有良好的抗肿瘤活性和可控的安全性,后续临床开发的推荐剂量为 6mg/kg Q3W;同时,该队列下的积极结果,也支持了后续十余项 III 期临床试验的开展。 HR+/HER2- BC 或 TNBC 队列 试验设计 在 HR+HER2- BC 或 TNBC 队列中,使用 NSCLC 队列推荐的剂量,即 6 mg/kg Q3W Dato-DXd 治疗,直到出现不可接受的毒性、疾病进展(PD)或撤回同意为止。 试验结果 截至 2022 年 7 月 22 日,共有 85 名患者接受了治疗,其中 HR+HER2- BC 患者 41 例,TNBC 患者 44 例。 HR+HER2- BC 和 TNBC 患者的研究持续中位时间分别为 13.7 个月和 19.3 个月;治疗持续中位时间分别为 4.8 个月和 4.3 个月。根据 BICR,HR+HER2- BC 患者和 TNBC 患者的 ORR 分别为 26.8%、31.8%。HR+HER2- BC 组的中位 DOR 无法评估,而 TNBC 组为 16.8 个月。HR+HER2- BC 和 TNBC 患者的中位 PFS 分别为 8.3 和 4.4 个月。 所有原因引起的 TEAEs (任何级别)在 HR+/HER2- BC 组和 TNBC 组中的发生率均为 100%,TEAEs≥3 级的发生率分别为 41.5%、52.3%。口腔炎是最常见的 TEAE (任何级别,≥3级),在 HR+/HER2- BC 组(82.9%,9.8%)和 TNBC 组(72.7%,11.4%)中均出现。 小结 在重度预处理的晚期 HR+HER2- BC 和 TNBC 患者中,Dato-DXd 表现出良好的临床活性和可控的安全性;该结果也为后续约五项围绕乳腺癌适应症开展的 III 期临床试验提供科学支持。 3.4 关键临床试验:精准设计和有效性确认 3.4.1 HR+HER2- 乳腺癌 试验设计 Dato-DXd 首次获得 FDA 批准上市是基于 TROPION-Breast01 的结果。 TROPION-Breast01 是一项全球、随机、多中心、开放性 III 期研究,共纳入 732 例乳腺癌患者,这些患者此前已接受过 1/2 线化疗,在不可切除或转移性治疗阶段出现疾病进展,且不适合继续接受内分泌治疗。将患者按 1:1 的比例随机分配到 Dato-DXd 组(n=365)或由研究者选择的化疗组(n=367)。该研究的主要终点是由 BICR 根据 RECIST 1.1 标准评估的 PFS 和总生存期 OS。 试验结果 截至到上市申请前,该项研究结果显示,中位随访 10.8 个月后,Dato-DXd 组经 BICR 评估的中位 PFS 较化疗组显著延长(6.9 个月 vs 4.9 个月),疾病进展或死亡风险降低 37%。 在 BLA 提交时,OS 数据尚不成熟(23% 数据完成,39% 信息量收集)。在 BLA 审核期间,申请人重新递交了 OS IA2 和 FA 结果。在 OS FA 时,OS 终点并未达到,Dato-DXd 组与 ICC 组的中位 OS 无差异,分别为 18.6 个月和 18.3 个月。尽管更为关键的 OS 数据不乐观,FDA 还是批准了 Dato-DXd 的上市申请。根据 FDA 审评报告,在 TB01 研究中,PFS 终点已达到,且 ORR 和耐受性较好,无明确的安全性风险;并且对于 HR+/HER2- 晚期乳腺癌患者来说,在标准治疗耐药后,治疗选择有限,存在巨大未被满足的临床需求;后线交叉治疗对 OS 的评估存在一定的影响。 在显著改善 PFS 但 OS 未显示出统计学或临床获益的情况下,药物仍有可能获得批准,类似案例并不少见,其具体原因需结合实际情况具体分析,不能一概而论。至此,我们对于那类旨在解决未满足临床需求、且已取得显著 PFS 获益的标志性药物是否仍具备上市前景的问题,或许可以稍感释然……. Dato-DXd 组的 ≥3 级 TRAEs 发生率低于 ICC 组(20.8% vs 44.7%)。Dato-DXd 组最常见 TRAEs 包括恶心(51.1%;≥3级为1.4%)和口腔炎(50%;≥3级为6.4%),而 ICC 组则为中性粒细胞减少症(42.5%;≥3级为30.8%)。 3.4.2 EGFR 突变非小细胞肺癌 在 NSCLC 这一全球发病率最高的癌种(年新增病例约 200 万)中,EGFRm 阳性患者占比达20%,而中国患者群体的这一比例更为突出。对于 EGFRm NSCLC 患者,现行治疗标准为 EGFR 靶向治疗及铂类化疗。然而,多数患者最终会发生耐药与疾病进展,后续的有效治疗选择极为有限。因此, Dato-DXd 新适应症(用于治疗既往接受过 EGFR 靶向治疗和铂类化疗的局部晚期或转移性 EGFRm NSCLC 成人患者)的获批,填补了肺癌治疗空白。该适应症的获批是 FDA 基于 TROPION-Lung05 II 期试验的亚组分析结果和 TROPION-Lung01 III 期试验数据的积极结果。 在 2024 年 EMSO 大会上,第一三共公布了 TROPION-Lung01/05 两项研究联合分析的重要结果,通过对 117 例 EGFRm 晚期 NSCLC 患者的疗效追踪(含 TROPION-Lung05 研究 78 例、Lung01 研究 39 例),为 Dato-DXd 在 EGFR-TKI 耐药人群的应用提供了更全面的循证支持。 图 11. TROPION-Lung05、TROPION-Lung01 汇总分析-试验设计 (图片源于 2024 ESMO 大会) 患者的主要 EGFR 突变类型包括 19 号外显子缺失(19del,51.3%)、21 号外显子 L858R 突变(21L858R,31.6%)和 20 号外显子 T790M 突变(27.4%)等;中位既往治疗线数为 3 线,且 82.1% 的患者接受过奥希替尼治疗。 图 12. TROPION-Lung05、TROPION-Lung01 汇总分析-入组基线(图片源于 2024 ESMO 大会) 结果显示,在总人群中经 BICR 评估的确认 ORR 为 42.7%(达到预设的统计学终点),其中 4.3% 的患者获得 CR ,中位 DoR 为 7.0 个月,DCR 为 86.3%,中位 PFS 为 5.8 个月,中位 OS 为 15.6 个月。在既往接受过奥希替尼治疗的人群中(n = 96),经 BICR 评估的确认 ORR 为 44.8%,其中 4.2% 获得CR,中位 DOR 为 6.9 个月,DCR 为 85.4%,中位 PFS 为 5.7 个月,中位OS 为 14.7 个月。 图 13. TROPION-Lung05、TROPION-Lung01 汇总分析-有效性结果(图片源于 2024 ESMO 大会) 在安全性方面,Dato-DXd 治疗的整体耐受性良好,不良事件可控。具体而言,患者接受 Dato-DXd 治疗的中位时间为 6.1 个月,严重或导致停药的 TRAEs 发生率较低,最常见的需特殊关注不良事件(AESIs)为口腔炎/口腔黏膜炎,但经过干预后,绝大部分都可以得到解决,且未发生导致停药的口腔炎。此外,研究过程中未发生 4-5 级药物相关间质性肺病,也无治疗相关死亡发生。 上述结果不仅验证了 Dato-DXd 在难治性 EGFR 突变人群的临床价值,更为后续治疗策略优化提供了重要参考。 图 14. TROPION-Lung05、TROPION-Lung01 汇总分析-小结(图片源于 2024 ESMO 大会) 截至上市申请前,TROPION-Lung05 和 TROPION-Lung01 的最新结果显示,Dato-DXd 在既往接受过治疗的局部晚期或转移性 EGFRm NSCLC 患者 (n=114) 中,经 BICR 确认的 ORR 为 45% (95% CI: 35-54),CR 和 PR 分别为4.4% 、40%,中位 DoR 为 6.5 个月(95% CI:4.2-8.4)。 图 16. Dato-DXd NSCLC 适应症获批文件 (图片源于 FDA ) TROP2 ADC 竞品分析 同一赛道下的机遇与挑战 目前,已获批上市的 TROP2 ADC 药物除了阿斯利康与第一三共合作开发的 Dato-DXd,还有吉利德公司研发的戈沙妥珠单抗和科伦博泰研发的芦康沙妥珠单抗。 戈沙妥珠单抗于 2020 年 4 月获 FDA 批准上市,用于既往治疗过的不可切除的局部晚期或转移性 TNBC 患者,是全球第一款获批的 TROP2 ADC;于 2023 年 2 月,其适应症得到拓展,获 FDA 批准用于既往接受过多种治疗但病情依旧进展的 HR+/HER2- 转移性乳腺癌患者。 芦康沙妥珠单抗于 2024 年 11 月在国内获批上市,用于既往至少接受过 2 种系统治疗的不可切除局部晚期或转移性 TNBC 患者;于 2025 年 3 月拓展适应症,用于治疗经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)和含铂化疗治疗失败的局部晚期或转移性 EGFRm NSCLC 患者;于2025 年 10 月再次拓展适应症,用于治疗经 EGFR-TKI 治疗后进展的 EGFRm 局部晚期或转移性非鳞状 NSCLC 成人患者。 虽同为 TROP2 ADC,但三种药物结构上存在诸多不同。戈沙妥珠单抗所用的 SN38 毒素抗肿瘤能力较强,芦康沙妥珠单抗采用了和戈沙妥珠单抗类似的 pH 依赖裂解方式,但在连接子方面进行了进一步的优化改造,使其半衰期更长,稳定性更高,二者平均 DAR 均为 8。Dato-DXd 进行了结构层面的升级,如亲和力较低的抗体降低了与正常组织的结合、DXd 抗肿瘤活性高、DXd 半衰期短、连接子稳定性高等,DAR 为 4。相同靶点、类似所用机制 Payload 的 ADC 产品,其临床有效性和安全性的比拼归根结底是分子设计、剂量优化、研发策略和治疗人群选择等多个维度。 尽管以 DXd 为基础的 ADC 在乳腺癌、肺癌等多种癌症治疗中取得了显著成效,但耐药性问题仍是临床上面临的主要障碍,主要包括内在耐药性和获得性耐药性。对此,目前临床上已经尝试开发新型 ADC 或选择联合治疗方案,以克服耐药性问题[12]。与此同时,安全性风险是另一大难题——临床数据显示,部分患者在接受 DXd-ADC 治疗时会出现 ILD、血液系统毒性、胃肠道反应、肝毒性等风险。为了减轻这些不良反应,正在进行的临床试验正在研究降低剂量、替代给药方案,以及开发安全性更高的下一代 ADC。此外,使用预测性生物标志物识别有严重毒性风险的患者,可能有助于定制治疗方案并最大限度地减少不良事件[12]。 综上,TROP2 ADC 在疗效与安全性方面奠定的坚实基础,结合 TROP2 靶点自身广阔的肿瘤表达谱,共同驱动了该领域的创新热潮——TROP2 双靶 ADC 产品层出不穷,研发最快的已经步入临床二期。 结语 Dato-DXd 的上市历程,不仅是一款新药的研发史,更是面对研发挫折时主动求变的典范,正是因为这样的韧性铸就了人类对抗癌症的智慧结晶。申请人凭借对肿瘤特异性表达靶点的深度了解,选择了在多种实体瘤中广泛表达的 TROP2 靶点,通过其独有的 DXd-ADC 技术平台开发了 Dato-DXd。在非临床研究阶段,尽管药效学研究所用的肿瘤模型与临床适应症并非完全对应,但仍为后续临床研究的“精准聚焦”提供了重要的转化依据;基于对产品特征的深入理解和前瞻性的研发策略,直接开展了三个月重复给药毒理试验,这不仅为临床起始剂量的设计和临床不良反应的预测提供了参考,也加速了临床研发进程。进入临床开发阶段,为应对未被满足的临床需求,率先聚焦于 NSCLC 和 BC 的后线单药治疗的探索。在 NSCLC 首次 NDA 遭遇挫折后,迅速调整策略和转变开发重心,并凭借亚群分析中的积极数据和后续研究的积极结果成功获得FDA的加速批准上市。与此同时,Dato-DXd 的应用边界也在不断拓展:一方面,从后线治疗拓展至一线治疗,全面布局未来市场;另一方面,从单药向联合用药延伸,引领治疗新趋势。 然而,TROP2-ADC 赛道的竞赛才刚刚开始。随着更多数据的披露和适应症的拓展, Dato-DXd 能否持续领跑?以 TROP2 为基石的双抗 ADC 等下一代 ADC 技术又将带来怎样的突破?这些问题,都将随着时间给出答案。但毋庸置疑的是,Dato-DXd 已经为 TROP2 相关癌症治疗开启了新篇章,也为众多癌症患者点燃了新的希望之光。