
2026-02-10 09:27:41来源: 注册圈浏览量:71
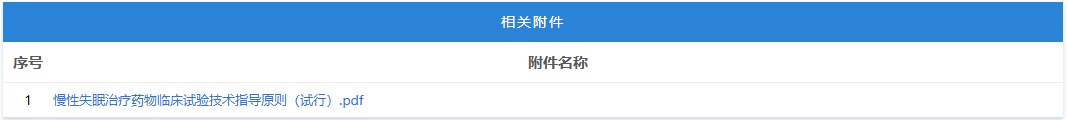
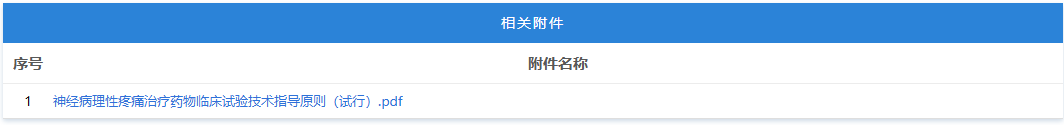
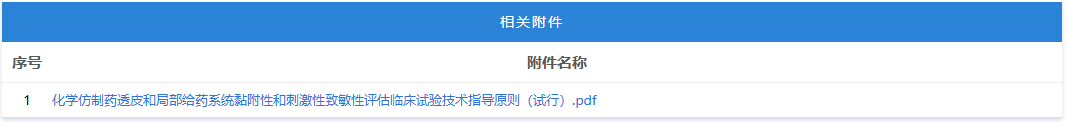
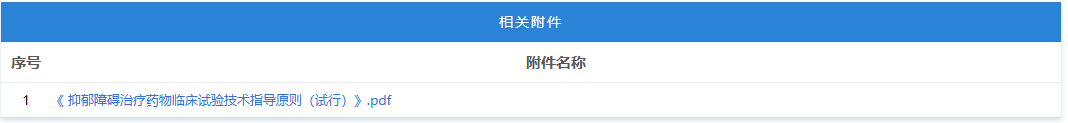
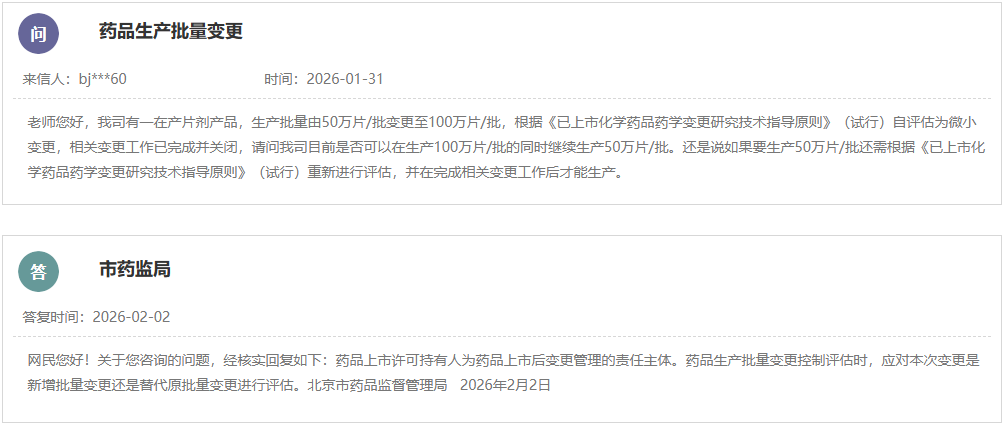
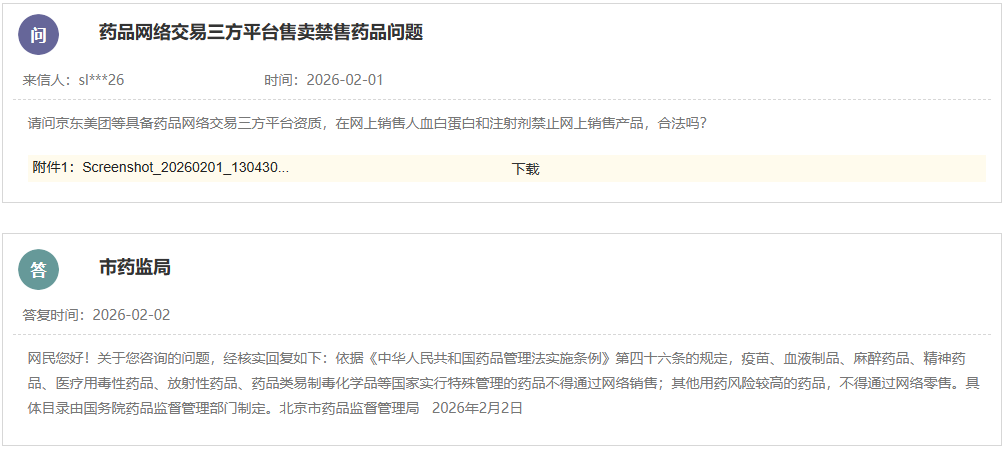
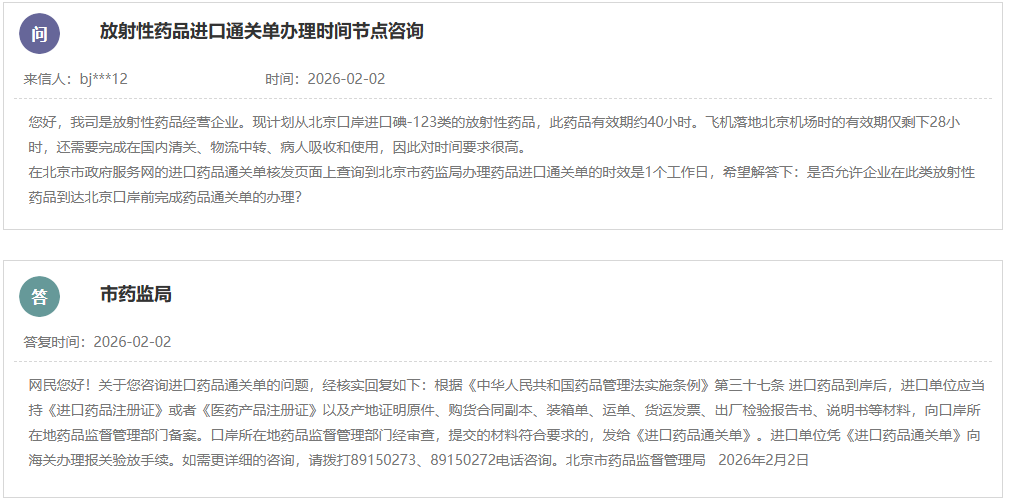
https://www.cde.org.cn/main/news/viewInfoCommon/8ef6c5163e703a6fd4829653678df473 按照国家药品监督管理局的部署,药审中心组织制定了《慢性失眠治疗药物临床试验技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。 特此通告。 附件:慢性失眠治疗药物临床试验技术指导原则(试行) 国家药监局药审中心 2026年1月5日 二、国家药监局药审中心关于发布《神经病理性疼痛治疗药物临床试验技术指导原则(试行)》的通告(2026年第9号) 网址: https://www.cde.org.cn/main/news/viewInfoCommon/911d5ec46a73b138c3fd6c2f39b340a6 按照国家药品监督管理局的部署,药审中心组织制定了《神经病理性疼痛治疗药物临床试验技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。 特此通告。 附件:神经病理性疼痛治疗药物临床试验技术指导原则(试行) 国家药监局药审中心 2026年1月22日 三、国家药监局药审中心关于发布《化学仿制药透皮和局部给药系统黏附性和刺激性/致敏性评估临床试验技术指导原则(试行)》的通告(2026年第14号) 网址: https://www.cde.org.cn/main/news/viewInfoCommon/16d9dbfe96cf3d22631670bdf6b763b1 按照国家药品监督管理局的部署,药审中心组织制定了《化学仿制药透皮和局部给药系统黏附性和刺激性/致敏性评估临床试验技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。 特此通告。 附件:化学仿制药透皮和局部给药系统黏附性和刺激性/致敏性评估临床试验技术指导原则(试行) 国家药监局药审中心 2026年1月29日 四、国家药监局药审中心关于修订发布《抑郁障碍治疗药物临床试验技术指导原则(试行)》的通告(2026年第11号) 网址: https://www.cde.org.cn/main/news/viewInfoCommon/993985b7016b2b88b0d5318d3a33086d 按照国家药品监督管理局的部署,药审中心组织修订了《抗抑郁药的药物临床试验指导原则》(原总局通告2018年第39号),形成《抑郁障碍治疗药物临床试验技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。参考《抗抑郁药的药物临床试验指导原则》正处于研发中的品种,可结合本指导原则进行试验方案优化或与药审中心进行沟通。 特此通告。 附件:抑郁障碍治疗药物临床试验技术指导原则(试行) 国家药监局药审中心 2026年1月26日 https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20260204142652180.html https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20260205105719180.html 按照《医疗器械监督管理条例》规定,根据企业申请,国家药品监督管理局现注销以下4家企业共11个产品的医疗器械注册证: 一、创生医疗器械(中国)有限公司的6个产品:脊柱通用后路内固定器,注册证编号:国械注准20183131872;脊柱通用后路内固定器,国械注准20153130585;椎体成形系统,注册证编号:国械注准20183041927;椎间融合器,注册证编号:国械注准20173130776;颈椎前路钢板系统,注册证编号:国械注准20193130052;椎板固定板系统,注册证编号:国械注准20213130982。 二、奥麦迪科斯有限公司All Medicus Co.,Ltd的3个产品:血糖试片(葡萄糖脱氢酶法)Blood Glucose Test Strips,注册证编号:国械注进20172406917;葡萄糖质控品Control Solution,注册证编号:国械注进20232400560;血糖监测仪Blood Glucose Test Meter,注册证编号:国械注进20172226843。 三、(株)五常医疗保健公司OSANG Healthcare Co.,Ltd.的1个产品:血糖测试片Blood Glucose Test Strips,注册证编号:国械注进20172402227。 四、爱诺生医疗股份有限公司Avanos Mecical,Inc.的1个产品:胃肠营养管Enteral Feeding Tubes,注册证编号:国械注进20192142387。 特此公告。 https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20260206110305143.html 在2025年国家药品抽检工作中,经甘肃省药品检验研究院等7家药品检验机构检验,发现有20家企业生产的27批次药品不符合规定。现将有关情况通告如下: 一、经甘肃省药品检验研究院检验,标示为邛崃天银制药有限公司生产的4批次贝诺酯颗粒不符合规定,不符合规定项目为溶化性。 二、经云南省食品药品监督检验研究院检验,标示为唐山红星药业有限责任公司生产的4批次醋酸曲安奈德乳膏不符合规定,不符合规定项目为含量测定。 三、经江苏省药品监督检验研究院检验,标示为澳美制药厂生产的2批次夫西地酸乳膏不符合规定,不符合规定项目为粒度。 四、经重庆市食品药品检验检测研究院检验,标示为Medochemie Ltd.欧洲塞浦路斯麦道甘美大药厂生产的1批次盐酸曲马多胶囊不符合规定,不符合规定项目为含量均匀度、含量测定。 五、经苏州市药品检验检测研究中心检验,标示为陕西恒诚制药有限公司生产的1批次珍菊降压片不符合规定,不符合规定项目为含量测定。 六、经湖南省药品检验检测研究院检验,标示为安徽省万生中药饮片有限公司、重庆吉凯药业有限公司、四川禾木源药业有限公司生产的共3批次红参(红参片)不符合规定,不符合规定项目为鉴别。 七、经甘肃省药品检验研究院检验,标示为湖北唐本草药业有限公司、湖南省大豪药业有限责任公司、成都中医大泰康医药科技有限责任公司、安顺市宝林科技中药饮片有限公司生产的共4批次蔓荆子(炒蔓荆子)不符合规定,不符合规定项目为浸出物。 八、经山西省检验检测中心检验,标示为河北美康药业有限公司、吉林敖东世航药业股份有限公司、吉林国安药业有限公司、安徽盛林国药饮片有限公司、湖北民泰药业有限责任公司、陕西广泰和药业有限公司、临洮四通药业有限责任公司、新疆爱康中药饮片有限公司生产的共8批次栀子不符合规定,不符合规定项目涉及性状、水分、重金属及有害元素。 对上述不符合规定药品,药品监督管理部门已要求相关企业和单位采取暂停销售使用、召回等风险控制措施,对不符合规定原因开展调查并切实进行整改。国家药监局要求相关省级药品监督管理部门依据《中华人民共和国药品管理法》,组织对上述企业和单位存在的涉嫌违法行为立案调查,并按规定公开查处结果。 特此通告。 附件:1.27批次不符合规定药品名单 2.不符合规定项目小知识 国家药监局 2026年1月30日 网址: https://www.cfdi.org.cn/cfdi/resource/news/16677.html 近日,国家药品监督管理局食品药品审核查验中心顺利通过ISO 9001质量管理体系外部监督审核。 审核期间,外审专家组通过现场询问、流程追溯及文件查阅等方式,对中心质量管理体系的运行情况进行了全面审查。专家组认为,中心质量管理体系持续符合ISO 9001标准及相关法规要求,运行有效,为检查核查工作的规范开展提供了坚实支撑。 核查中心自2012年首次获得ISO质量管理体系认证以来,持续完善体系、优化运行。下一步,核查中心将继续对标国际标准,不断优化质量管理体系,切实保障药品检查核查质量,服务医药产业高质量发展。 一、山东省药品监督管理局 (一)山东省药品监督管理局关于发布花生红衣等中药材标准及饮片炮制规范的公告 网址: http://mpa.shandong.gov.cn/col/col101747/art/2026/art_eac4fdbe49cf46b8b42f5afb088923d6.html 关于发布花生红衣等中药材标准及饮片炮制规范的公告 根据《中华人民共和国药品管理法》及有关规定,我局已组织完成花生红衣、粳米饮片炮制规范的制定及蜂王浆冻干粉药材标准、蜂王浆冻干粉饮片炮制规范、花生红衣药材标准的修订工作,经审查,现予发布,自 2026 年 8 月 1 日起实施。新标准实施之日起,原蜂王浆冻干粉药材标准、蜂王浆冻干粉饮片炮制规范、花生红衣药材标准同时废止。 特此公告。 附件:1.花生红衣饮片炮制规范SDPZGF2022-Z-001.pdf 2.粳米饮片炮制规范SDPZGF2022-Z-002.pdf 3.花生红衣药材标准SDZYC2022-X-001.pdf 4.蜂王浆药材标准SDZYC2022-X-002.pdf 5.蜂王浆饮片炮制规范SDPZGF2022-X-001.pdf 山东省药品监督管理局 2026年2月2日 (二)媒体解读:《山东省药品监督管理局药品生产检查实施办法》印发 网址: http://mpa.shandong.gov.cn/col/col267475/art/2026/art_4e571fb267cf469c96c00ca02683db30.html 中国食品药品网讯 近日,山东省药监局印发《山东省药品监督管理局药品生产检查实施办法》(以下简称《实施办法》),进一步规范全省药品生产检查行为,提升监管效能。《实施办法》自2026年3月1日起施行。 《实施办法》包括总则、检查计划制定、检查实施、检查报告评定和结果处理、跨省检查的协作、检查管理、附则七章,共四十一条。 《实施办法》坚持服务与监管并重,推动检查多元化与协同化。《实施办法》要求依据风险评估和检查融合原则制定药品生产年度监督检查计划,可融合许可检查、注册核查、常规检查等检查类型,制定融合开展的检查报告模板,实现“进一次门 办多件事”。与此同时,鼓励各单位充分运用信息化监管手段,结合检查任务和被检查单位信用管理等实际情况,探索采取数据比对分析、大数据筛查、远程检查、材料审查等手段开展非现场监管。 《实施办法》细化检查实施全过程要求,对检查准备、现场实施、缺陷分级、结论形成等关键环节作出明确规定,统一操作标准,强化检查的程序性和一致性。对于跨省委托生产情形下的联合检查、协查和延伸检查,《实施办法》作出专章规定,健全跨区域协作机制。 《实施办法》强化检查管理和责任落实,明确药品检查人员责任,并提出建立健全药品生产检查员的考核评价机制,将检查过程与结果的质量、检查问题的发现率及风险研判能力作为考核管理的重要参考,持续提升检查效能和风险防控水平。 此外,《实施办法》还在附件中明确药品生产现场检查优化情形,系统梳理了书面审查、优化检查、优先检查和不得减免检查等具体情形,实现分类监管和精准监管,将有限的检查资源聚焦于关键风险和重点环节。 二、浙江省药品监督管理局 (一)浙江省药品监督管理局2026年拟新增检查员名单公示(第1批) 网址: https://mpa.zj.gov.cn/art/2026/2/6/art_1228989285_58943488.html 为进一步加强全省职业化专业化检查员队伍建设,根据《浙江省药品检查员准入退出办法》(浙药检管〔2022〕8号)规定,经个人申请、岗前培训、见习检查、准入评估等程序,拟新增药品生产检查员1人、药品流通检查员5人、医疗器械生产检查员16人、化妆品生产检查员5人,现予以公示,请社会各界予以监督。 公示时间:2026年2月6日—2月14日。 如对公示结果有异议的,请在公示期间以书面或电话形式向浙江省药品检查中心反映。联系人:刘瑶,联系电话:0571-89775015。 附件:浙江省药品监督管理局2026年拟新增检查员名单(第1批) 浙江省药品监督管理局 2026年2月6日 附件 三、北京市药品监督管理局 (一)北京市药品监督管理局关于对外联系电话变更的公告 网址: https://yjj.beijing.gov.cn/yjj/zwgk20/gg17/743916371/index.html 为进一步规范政务服务渠道,提升沟通响应效能,方便公众咨询办事,根据工作安排,我局对外联系电话将进行变更,现将具体事宜公告如下: 一、变更内容 对外综合联系电话、政府信息公开电话、信访电话原号码010-55527322,变更为010-55529963。接听时间:9:00-12:00,14:00—18:00(工作日)。 二、生效时间 1.新号码启用时间:2026年2月2日起正式启用。 2.过渡期安排:2026年2月2日至2026年2月28日为过渡期,期间新旧号码并行使用。过渡期结束,原号码停止使用,届时请通过新号码办理相关业务。 三、相关说明 请广大市民、相关单位相互转告,优先使用新号码咨询办理业务。因电话变更给您带来的不便,敬请谅解。感谢您对我局工作的支持与配合! 特此公告。 北京市药品监督管理局 2026年2月2日 (二)新增3个共性问题 网址: https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/xx-yjj.html 四、广东省药品监督管理局 (一)新增1个共性问题 网址: http://mpa.gd.gov.cn/dawenku/yaopin/content/post_4851350.html Q:申请化学药制剂注册检验时,什么情况下需要一并提供相应化学原料药样品和相关资料? A:《药品注册检验工作程序和技术要求规范(试行)》(2020年版)明确,因化学药制剂审评和制剂注册检验需要对化学原料药进行检验的,应当一并抽取或提供化学原料药样品和相关资料。一种情况是审评中心基于制剂审评需要启动化学原料药的检验;另一种情况是药品检验机构基于制剂注册检验需要,要求申请人提供原料药。此种情况,在注册检验申请前,由申请人和检验机构提前沟通确定。 (二)广东省药品监督管理局 广东省卫生健康委员会关于发布粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录(2025版)的通告 网址: http://mpa.gd.gov.cn/zwgk/gzwj/content/post_4851554.html 根据《广东省粤港澳大湾区内地九市进口港澳药品医疗器械管理条例》以及《广东省粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录管理办法》有关规定,经广东省药品监督管理局、广东省卫生健康委员会研究,决定发布《广东省粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录(2025版)》(以下简称2025版目录)。2025版目录共收录药品及医疗器械115个,其中药品45个、医疗器械70个。 自通告发布之日起,指定医疗机构申请进口使用2025版目录内品种的,按照目录内流程和要求进行申报。原《广东省粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录(2024年)》自通告发布之日起予以废止。 特此通告。 附件:1.广东省粤港澳大湾区内地九市临床急需进口港澳药品目录(2025版) 2.广东省粤港澳大湾区内地九市临床急需进口港澳医疗器械目录(2025版) 广东省药品监督管理局 广东省卫生健康委员会 2026年1月28日 (三)《粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录(2025版)》政策解读 网址: http://mpa.gd.gov.cn/zwgk/gzwj/content/post_4852971.html 根据《广东省粤港澳大湾区内地九市进口港澳药品医疗器械管理条例》(以下简称《条例》)以及《广东省粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录管理办法》(以下简称《办法》)有关规定,广东省药品监督管理局会同广东省卫生健康委员会,联合发布《粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录(2025版)》(以下简称2025版目录)。作为《办法》实施后的首次目录发布,2025版目录在遴选机制、品种范围、流程管理等方面进一步完善和创新,收录药品及医疗器械共115个,其中药品45个,医疗器械70个。 一、目录编制背景 2025版目录在2024版基础上,严格按照《条例》及《办法》规定,参考国家临床急需药械引进机制,建立引领性品种遴选机制,旨在精准匹配临床需求,让患者更快用上港澳地区已上市的先进药械。 二、目录核心亮点 (一)建立引领性品种遴选机制,实现从“被动收录”到“主动引领” 本次目录创新性引入引领性品种遴选模式,通过国家已发布且已在港澳上市的临床急需品种、预审库收集品种、临床专家推荐品种、企业推荐品种等四大渠道,累计收集129个候选品种。经广东省药品监督管理局审评认证中心两轮审核筛选,以及临床、药学、不良反应等领域专家评审,最终确定16个引领性品种,包括治疗短肠综合征、先天性血栓性血小板减少性紫癜等罕见病的孤儿药,以及外科手术机器人、消化道功能性腔内成像系统等高端诊疗设备。这一机制将推动品种收录机制从“被动收录”转向“主动引领”,进一步扩大“港澳药械通”品种范围。 (二)品种覆盖多个临床场景,填补国内诊疗空白 2025版药品目录既涵盖淋巴瘤、神经性头痛等常见病的新靶点治疗药物,也包含4种罕见病的孤儿药,填补国内相关病种治疗空白;医疗器械目录聚焦精准诊疗需求,纳入外科手术机器人、肿瘤磁性定位系统等高端设备,提升大湾区内地九市指定医疗机构对复杂疾病的诊疗能力。同时,药品目录主动衔接国家临床急需药械目录,其中4个品种属于国家临床急需药械目录范围,实现国家与地方政策的精准协同。 (三)全流程规范管理,确保目录科学性与时效性 作为《办法》实施后的首次目录发布,本次目录收集严格落实《办法》规定的全流程管理要求,从纳入标准设定,到多渠道征集、专家评审的全流程,均以临床急需性、技术先进性、使用安全性为核心判断依据。同时,建立目录动态调整机制,对已在境内上市的品种及时予以剔除,确保目录始终贴合临床最新需求,避免资源浪费。 2025版目录的发布,是“港澳药械通”政策的进一步深化和完善,将为大湾区居民提供更优质、更便捷的医药医疗服务保障。下一步,广东省药品监督管理局将继续加强与港澳地区监管协作,不断优化目录管理机制,为大湾区医药医疗事业高质量发展注入新动力。 (四)国家药品标准颁布件(202512) 网址: http://mpa.gd.gov.cn/zwgk/jgsz/zcc/zlbzj/content/post_4853186.html






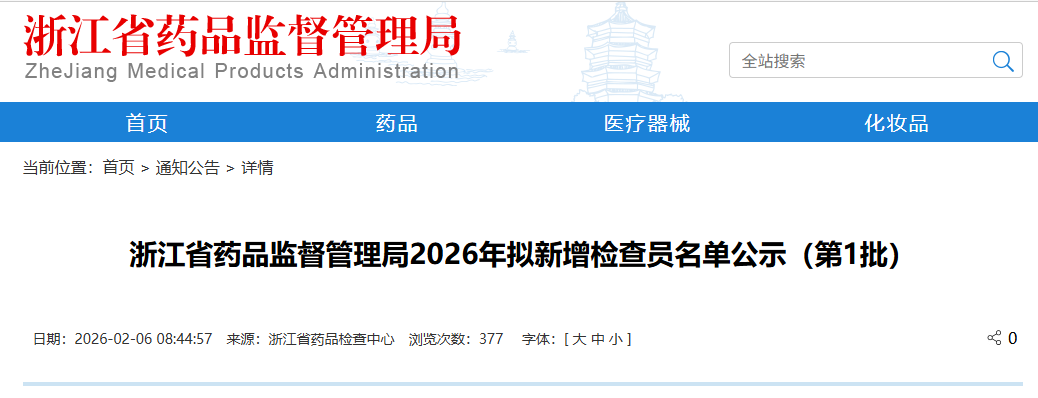
浙江省药品监督管理局2026年拟新增检查员名单(第1批)

声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容