2025-05-15 11:30:10来源:CDE浏览量:3723
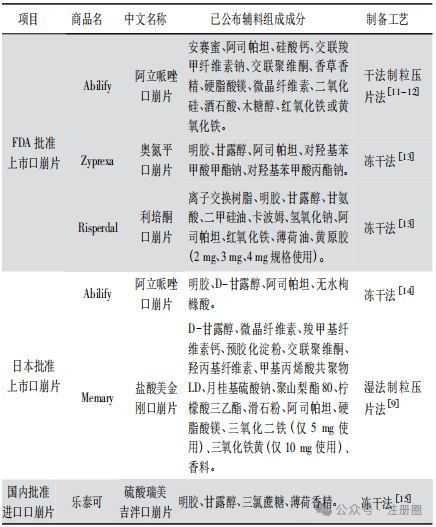
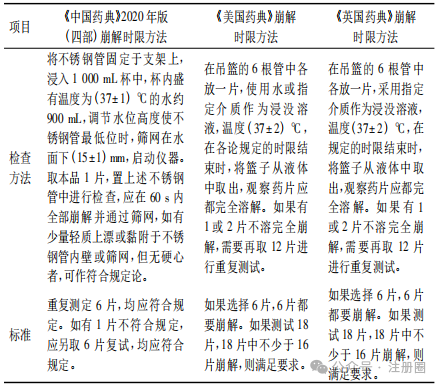
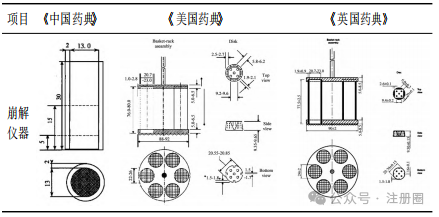
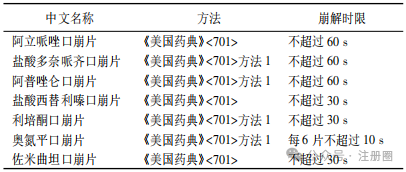
口崩片系指在口腔内不需要用水即能迅速崩解或溶解的片剂。口崩片作为片剂剂型之一,具有服用方便、在口腔内迅速崩解或溶解等优势,有助于改善患者用药依从性。本文结合口崩片相关指导原则、药典标准及上市药品情况,对口崩片处方工艺、质量研究和质量控制、稳定性和包装等方面进行探讨。希望有助于口崩片的开发,期待更多高质量口崩片上市,满足特定患者的用药需求。 【关键词】口崩片; 处方工艺; 质量控制; 稳定性和包装; 新药注册 口服给药途径是固体和液体制剂最普遍和推荐的给药方式[1]。片剂以口服普通片为主,另有含片、舌下片、咀嚼片、分散片、可溶片、泡腾片、缓释片、肠溶片与口崩片等。口崩片在特定疾病治疗及特定人群使用方面具有一定优势,与口服普通片相比,口崩片服用方便( 无需用水) 、在口腔内迅速崩解或溶解,能够解决部分患者的吞咽困难问题,如老人和儿童,中风、卧床、食道问题、精神障碍患者等,从而改善患者用药依从性,同时对旅行或者用水不便的人也是有益的[2-5]。目前,口崩片在全球上市品种越来越多,截至 2024 年 11 月,我国已批准具有有效批准文号的化学口崩片药物约 43 种,主要为神经系统、消化系统、内分泌系统药物。 口崩片的研发除遵循普通口服片剂药学要求外,还应满足迅速崩解或溶解、口感良好、容易吞咽,对口腔黏膜无刺激性等,在处方工艺和质量研究等方面应予以特殊关注。目前国内尚无口崩片药学研究技术指导原则发布。本文对口崩片国内外药典、指导原则及已上市药品进行梳理,结合审评工作,重点对口崩片的处方及生产工艺、质量研究和质量控制、稳定性和包装等方面进行介绍和探讨,希望为口崩片药学研究提供参考。 药典中口崩片定义 《中国药典》2020 年版( 四部) 0101 片剂通则[6]中口崩片定义为“在口腔内不需要用水即能迅速崩解或溶解的片剂”。《欧洲药典》中口崩片定义为“一种无包衣片剂,吞咽前便在口腔中迅速分散。崩解试验使用水作为溶剂,在 3 min 内解。”《日本药典》中口崩片定义为“在口腔内迅速溶解或崩解进行服用的药片”。《美国药典》中定义口崩片为“可以放在舌头上服用,当接触到唾液会迅速崩解,因此不需要咀嚼、整片吞咽、用水服用”。《中国药典》和《美国药典》中明确了口崩片的使用方法不需要用水,《欧洲药典》和《日本药典》未明确说明。2020 年国家药典委员会公布的“关于盐酸格拉司琼口崩片国家药品标准草案”的公示中规定盐酸格拉司琼口崩片在口腔内迅速崩解,无砂砾感,口感良好[7]。 口崩片药学研究关注点 口崩片的药学研究可遵循普通口服固体制剂的相关要求,参考 ICH Q8 等指导原则,结合产品临床目标人群的用药需要、口崩片制剂特点和原料药特性,科学合理设计试验,重点关注口崩片硬度、脆碎度、崩解时限、溶出度和口感( 包括砂砾感) 等关键质量属性。此外,产品开发时还需要考虑片剂的大小、片重、组成成分的溶解性以及这些因素对口崩片及其用途的影响。通过产品开发确定辅料种类及用量,稳定的生产工艺,合理的过程控制参数,确保产品质量符合预期质量要求。 需要说明的是,药学研究工作正式开展前,应充分论证产品立题合理性及注册分类。如按仿制药进行开发,应先按国家局参比制剂遴选程序确认参比制剂; 如按改良新药进行开发,需要结合药物及临床应用特点,充分论证口崩片剂型合理并评估临床优势后再开展研发工作。 2.1 处方开发 口崩片可参考 ICH Q8 等技术指导原则,通过处方开发确定合理处方。在口崩片药物设计和开发时,首要考虑在唾液中应能迅速崩解或溶解,无需咀嚼或使用液体服用,崩解时限不能过长[8]。如果崩解时间太长或者需要液体服用,美国食品药品监督管理局( FDA) 认为不适合开发成口崩片[8]。此外,应根据目标患者人群,设计合适的大小、片重和口感等,以提高患者用药依从性,如对于儿童患者可设计小片径的口崩片以便服用; 片重不宜过大,FDA 观点建议不超过 500 mg[8]; 口感应良好,无明显砂砾感或过多残渣等。在人体生物等效性试验或临床试验研究期间,也建议一并收集与上述患者用药依从性相关的信息,如口腔内崩解时限、口感( 包括沙砾感) 和局部刺激性等信息,指导处方开发和优化。 2.1.1 原料药 《中国药典》2020 年版( 四部) 0101片剂通则中指出口崩片一般适合于小剂量原料药物。目前口崩片规格一般在零点几毫克到两百毫克左右,大部分规格均在几毫克到几十毫克,故口崩片开发时,建议片重尽量要低。原料药理化性质需要关注溶解度、口感、晶型、粒度及粒度分布等的研究和控制。对于小规格制剂,关注原料药物料特性( 如粒度及粒度分布、密度) 对制剂工艺及含量均匀度的影响,制定相应控制策略。对于原料药苦味特别大、刺激性较强的或剂量较大,通常不适宜开发成口崩片。 口崩片辅料应根据辅料特性及其在口崩片中的作用进行选择,对可能影响口崩片硬度、脆碎度、崩解时限、口感( 包括砂砾感) 和溶出度等关键质量属性的辅料功能性相关指标进行考察。口崩片辅料选择时关注水不溶性辅料的使用,以免造成产品明显砂砾感。在开发儿童口崩片时,需要关注辅料用量是否对儿童产生毒副作用,儿童患者与成人患者在口感方面可能存在差异。 填充剂是口崩片的主要组成辅料,常用填充剂包括甘露醇、微晶纤维素、木糖醇、预胶化淀粉、玉米淀粉、明胶、乳糖等。填充剂的选择应关注填充剂号及用量的可压性,对硬度、脆碎度、片重差异、崩解时限、口感和溶出度等影响。 崩解剂是口崩片的发挥制剂崩解特性的关键辅料,常用崩解剂包括交联羧甲纤维素钠、交联聚维酮、低取代羟丙基纤维素、羧甲淀粉钠、羧甲基纤维素、羧甲纤维素钙等。崩解剂的选择应关注崩解剂型号及用量对硬度、脆碎度、崩解时限、口感和溶出度等的影响。 口崩片应口感良好,对口腔黏膜无刺激性,根据依从性的需要,可添加矫味剂等或采用合适的掩味技术改善口感。例如,美国上市阿立哌唑口崩片采用矫味剂木糖醇、安赛蜜、阿司帕坦、香草香精进行矫味; 日本上市盐酸美金刚口崩片采用矫味剂阿司帕坦和香料进行矫味,辅料甲基丙烯酸共聚物 LD可能为包衣材料,以掩盖原料药的苦味,提高顺应性,专利显示采用颗粒压片包衣[9]。目前已上市口崩片普遍选择采用一种或多种矫味剂进行矫味,常用矫味剂包括阿司帕坦、三氯蔗糖、安赛蜜、香精、无水枸橼酸、木糖醇、薄荷脑等。可采用口尝试验、电子舌或其他科学方法对产品口感进行评价,建议关注砂砾感、苦味和刺激性等指标的口感评价,可参照《儿童用药口感设计与评价的技术指导原则》[10]。 不同生产工艺( 如压片法和冷冻干燥法) 口崩片在辅料选择上具有一定差异,表 1 汇总了不同制备工艺的口崩片辅料组成情况,通常冷冻干燥法与压片法相比,具有明显的孔隙,崩解速度更快,使用辅料种类和用量相对较少。已上市冻干型口崩片常使用明胶、甘露醇作为填充剂。 ▲表1-不同制备工艺的口崩片辅料组成 2.2 生产工艺开发 应根据口崩片特性,基于已有的生产经验、文献及参比制剂公开信息,参考 ICH Q8 等技术指导原则,选择合适制备工艺,并选择合理的考察指标对工艺进行全面的研究和验证,最终得到持续稳定的生产工艺。 口崩片的性能取决于其制备中使用的技术[2]。《中国药典》2020 年版( 四部) 0101 片剂通则介绍了口崩片可采用直接压片和冷冻干燥法制备。基于审评情况来看,口崩片注册工艺较多采用湿法制粒压片和干法制粒压片技术。压片型口崩片的生产流程同普通片剂基本一致,一般包括配料、制粒、混合、压片和包装等工序,其中混合和压片工序是口崩片生产的关键步骤。混合工艺应关注混合物料的流动性和可压性,需要对混合步骤的仪器设备选择、加料顺序、混合时间、混合速度、取样点数量与位置进行研究。对于小规格制剂等混合均匀性风险较高的产品,应根据工艺开发、工艺验证等积累的数据确定商业化生产混合均匀度样品的取样方式及混合均匀度控制标准。混合均匀度研究可参考《化药口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则》[16]进行研究。压片工序工艺参数关注点与普通片剂基本一致。 冻干型口崩片是一种采用冷冻干燥工艺通过低压升华快速除去水分,获得疏松多孔的骨架结构,可快速崩解的速释制剂。冻干型口崩片工艺流程一般包括药液制备、药液灌装、速冻( 预冻) 、冷冻干燥和包装等步骤。冻干型口崩片在冻干前如为混悬状态存在,建议结合工艺研究及工艺验证情况,制定控制措施确保各工艺阶段物料混合均一及成品含量均匀度符合要求。速冻工序需要较低温度时常采用液氮作冷却剂,可实现快速冷冻制剂。冷冻干燥工序是冻干型口崩片生产的关键步骤,需要重点关注冷冻干燥阶段速冻温度和时间、冻干工艺参数等,以及冻干的装载量和装载方式。 2.3 质量研究与质量控制 口崩片的关键质量属性通常包括但不限于性状、崩解时限、硬度、脆碎度、含量、含量均匀度、溶出度、有关物质、水分、微生物限度等,可按照化学药品质量控制相关指导原则开展研究。 2.3.1 崩解时限和溶出度 崩解时限和溶出度作为口崩片的关键质量属性,在处方工艺开发、质量研究和稳定性研究都应该予以足够重视。《中国药典》2020 年版( 四部) 0101 片剂通则介绍了口崩片除冷冻干燥法制备的口崩片外,口崩片应进行崩解时限检查[《中国药典》2020 年版( 四部) 通则 0921]。对于难溶性原料药物制成的口崩片,还应进行溶出度检查[《中国药典》2020 年版( 四部) 通则 0931],溶出度检查仪器与方法与片剂一致。对于经肠溶材料包衣的颗粒制成的口崩片,还应进行释放度检查[《中国药典》2020 年版( 四部) 通则 0931]。 表 2 和表 3 汇总了各国药典崩解时限测定方法和崩解仪器,《美国药典》和《英国药典》测定方法和崩解仪器基本一致,崩解仪包含一个吊篮和 1 L 烧杯,吊篮由 6 根开放式透明管组成,升降的金属支架上下移动距离为( 55±2) mm,往返频率 30 ~ 32 次/min。《中国药典》崩解仪器主要结构为一能升降的支架与下端镶有筛网的不锈钢管,升降的支架上下移动距离为 9~11 mm,往返频为 30 次/min。 ▲表2-国内外药典崩解试验分析方法及限度要求 ▲表3-国内外药典崩解试验仪器结构 FDA 口崩片指导原则中介绍采用《美国药典》<701>崩解时限方法或替代方法测定崩解时限,限度约为 30 s 或者更少。《欧洲药典》规定口崩片在水中崩解时限为 3 min,《中国药典》规定口崩片在水中的崩解时限不超过 60 s。目前《中国药典》仅收载了阿立哌唑口崩片、利培酮口崩片,均未控制崩解时限。《美国药典》收载部分口崩片的崩解时限汇总如表 4,基本不超过 60 s。基于国内外已批准上市产品崩解时限以及《中国药典》规定,建议申请人制定质量标准中崩解时限不超过 60 s。 ▲表4-美国批准上市口崩片崩解时限 国家药品监督管理局药品审评中心于 2023 年 12月在信息公开仿制药共性问题中解答了“枸橼酸西地那非口崩片崩解时限研究需要关注哪些问题”,内容为“对于口崩片,崩解时限是关键质量属性”。现版《中国药典》收载了专用于口崩片崩解时限检查的装置,该装置为《中国药典》所特有。枸橼酸西地那非口崩片收载于《英国药典》,采用普通崩解时限装置进行崩解时限研究。在进行仿制药崩解时限研究时,建议首选《中国药典》口崩片崩解时限专用装置进行仿制药与参比制剂对比研究,应符合《中国药典》附录规定限度。如采用普通崩解时限装置进行崩解时限检查,建议同时采用两种装置进行仿制药与参比制剂对比研究,详细记录崩解时间及现象,说明不采用《中国药典》口崩片专用崩解时限装置的依据,并拟订合理限度”[18]。基于审评经验,对于其他口崩片产品也可参照上述答复进行崩解时限研究。申报资料中应明确仪器装置、崩解介质、温度、体积、崩解现象、限度要求等。此外,建议产品开发时建立合适的体外试验来模拟口崩片在口腔内给药实际情况,参考同类产品及文献研究方法,采用少量溶剂建立崩解时限检查方法,拟定合理控制限度。检查方法可为动态崩解测定法或静态崩解测定法,少量溶剂可选择如水、人工唾液等,根据产品特性开发出合理的崩解时限的方法,关注方法体内外相关性,如采用将口崩片放入崩解篮再放入少量溶剂中; 将口崩片直接放入少量溶剂的试管和烧杯中; 设计装置考察口崩片在少量溶剂情况下能否通过筛网等方法。静态方法开发过程中关注少量溶剂体积和温度的选择,动态方法还要关注转速等,为了建立可行的方法,必要时可同时设计几个试验进行比较,仿制药开发时建议与参比制剂进行对比研究。 对于溶出度,应基于原料药的理化性质以及制剂特性,参考《普通口服固体制剂溶出度试验技术指导原则》等技术要求,研究建立溶出行为考察和溶出度检查方法,并对方法的区分力进行考察,制定合理的溶出度控制限度。 2.3.2 脆碎度 口崩片通常应进行脆碎度检查,可采用《中国药典》片剂脆碎度检查法<0923>。考虑到冷冻干燥法制备的口崩片特殊性,可不进行脆碎度检查。在脆碎度检查时,对易吸潮的产品,操作时应注意防止吸湿( 通常控制相对湿度小于 40%) 。 2.3.3 其他 对于口崩片其他关键质量属性,如含量、含量均匀度、有关物质、硬度、残留溶剂、水分、微生物限度等,建议参照相关技术要求开展研究。 仿制药应与参比制剂进行全面的质量对比研究,且质量不低于参比制剂。存在功能性刻痕的口崩片需参照《化学仿制药口服片剂功能性刻痕设计和研究技术指导原则》[17]进行研究,在质量标准性状项下需要增加刻痕描述。 除常规理化特性对比外,药学开发及临床期间应关注口感( 包括砂砾感) 等数据的收集。 2.4 稳定性和包装 按照 ICH Q1、《化学药物( 原料药和制剂) 稳定性研究技术指导原则( 修订) 》[19]等开展口崩片稳定性研究。稳定性考察指标应包括脆碎度、水分、溶出度、崩解时限等口崩片特性指标。对于多剂量包装的产品,应结合临床使用情况、参考相关指导原则进行使用中稳定性试验。仿制药的稳定性结果应不低于参比制剂。口崩片包装形式和普通片剂基本一致,对易吸湿口崩片,应选择密封性和防水性较好的包装材料,包装内也可添加干燥剂,如硫酸瑞美吉泮口崩片包装采用聚氯乙烯/聚酰胺/铝/聚酰胺/聚氯乙烯冷冲压成型固体药用复合硬片,并用可剥离铝箔密封;阿立哌唑口崩片内包装为铝泡罩包装。 结语 口崩片与传统口服普通片剂相比,具有服用方便、在口腔内迅速崩解或溶解等优势,有助于改善患者用药依从性,对儿童和老年等吞咽困难患者来说是一种较为理想的选择。本文汇总梳理国内外药典标准及指导原则,结合审评工作,重点对口崩片处方开发、生产工艺开发、质量研究与质量控制、稳定性和包装等方面药学关注点进行介绍。申请人在开发口崩片时应结合剂型特点、临床需求、参比制剂信息等综合考虑立题合理性,研发出更多高质量口崩片产品。希望通过上述介绍,能够有助于口崩片类产品的开发,满足特定患者的用药需求。